вибір читачів
Популярні статті
Стан твердих і м'яких тканин порожнини рота визначається кількістю і властивостями слини, яка виділяється слинними залозами, розташованими в передньому відділі травного тракту людини.
У слизовій оболонці язика, губ, щік, твердого та м'якого піднебіння розташовані численні дрібні слинні залози. За межами порожнини рота є 3 пари великих залоз - привушні, под'- мовні і подніжнечелюстние і сполучених з нею за допомогою проток.
6.1. БУДОВА І ФУНКЦІЇ слинних залоз,
Великі слинні залози відносяться до альвеолярно-трубчастих і складаються з секреторних відділів і системи шляхів, що виводять слину в порожнину рота.
У паренхімі слинних залоз виділяють кінцевий відділ і систему вивідних проток. Кінцеві відділи представлені секреторними і міоепітеліальние клітинами, які зв'язуються через десмосоми з секреторними клітинами і сприяють виведенню секрету з кінцевих відділів. Кінцеві відділи переходять у вставні протоки, а вони, в свою чергу, в смугастих протоки. Для клітин останніх характерна наявність розташованих перпендикулярно до базальної мембрані витягнутих мітохондрій. У апікальних частинах цих клітин присутні секреторні гранули. Односторонній транспорт слини забезпечується резервуарними і клапанними структурами, а також м'язовими елементами.
Залежно від складу слини, що виділяється розрізняють білкові, слизові і змішані секреторні відділи. Привушні слинні залози і деякі залози мови виділяють рідкий білковий секрет. Дрібні слинні залози виробляють більше густу в'язку слину, що містить глікопротеїни. Піднижньочелюсних і під'язикові, а також слинні залози губ, щік і кінчика язика виділяють змішаний білково-слизовий секрет. Більшу частину слини утворюють подніжнечелюстние слинні залози (70%), привушні
(25%), під'язикові (4%) і малі (1%). Така слина називається власне слиною або проточною слиною.
Функції слинних залоз
секреторна функція . В результаті секреторної діяльності великих і малих слинних залоз зволожується слизова оболонка рота, що є необхідною умовою для здійснення двостороннього транспорту хімічних речовин між слизовою оболонкою рота і слиною.
Видільна (інкреторна) функція . Зі слиною виділяються різні гормони - глюкагон, інсулін, стероїди, тироксин, тиреотропин і ін. Інкретіруются сечовина, креатинін, деривати лікарських засобів і інші метаболіти. Слинні залози мають вибіркову транспортом речовин з плазми крові в секрет.
Регуляторна (інтегративна) функція . Слинні залози мають ендокринної функцією, яка забезпечується завдяки синтезу в ній паротин і факторів росту - епідермального, інсуліноподібного, зростання нервів, росту ендотелію, росту фібробластів, які надають як паракринное, так і аутокринное дію. Всі ці речовини виділяються як в кров, так і в слину. Зі слиною в незначи- тільних кількостях вони виділяються в порожнину рота, де сприяє швидкому загоєнню ушкоджень слизової оболонки. Паротин також надає дію на епітелій слинних залоз, стимулюючи синтез білка в цих клітинах.
6.2. МЕХАНІЗМ секреції СЛИНИ
секреція- внутрішньоклітинний процес надходження в секреторну клітину речовин, освіти з них секрету певного функціонального призначення і подальше виділення секрету з клітини. Періодичні зміни в секреторною клітці, пов'язані з утворенням, накопиченням, виділенням секрету, і відновлення шляхом подальшої секреції називається секреторним циклом. Виділяють від 3 до 5 фаз секреторного циклу, і для кожної з них характерно специфічне стан клітини і її органел.
Цикл починається з надходження в клітину з плазми крові води, неорганічних і низькомолекулярних органічних сполук (амінокислоти, моносахариди та ін.) Шляхом піноцитозу, дифузії і активного транспорту. Надійшли в клітку речовини використовуються для синтезу
секреторного продукту, а також для внутрішньоклітинних енергетичних і пластичних цілей. У другій фазі формується первинний секреторний продукт. Ця фаза істотно розрізняється залежно від виду утвореного секрету. У кінцевій фазі відбувається виділення секретор- ного продукту з клітки. По механізму виділення слини секреторними відділами все слинні залози відносяться до екзокринні-мерокриновому. В цьому випадку секрет виділяється з клітини без руйнування залізистих клітин в розчиненому вигляді через її апикальную мембрану в просвіт ацинуса, а в подальшому надходить в порожнину рота (рис. 6.1).
Активний транспорт, синтез і секреція білків вимагають витрати енергії молекул АТФ. Молекули АТФ утворюються при розпаді глю- кози в реакціях субстратного і окисного фосфорилювання.
Освіта первинного слинного секрету
Секрет слинних залоз містить воду, іони і білки. Специфіка і виділення різних за складом продуктів секреції дозволили виявити секреторні клітини з трьома видами внутрішньоклітинних конвеєрів: білковим, слизовим і мінеральним.
Освіта первинного секрету пов'язано з рядом факторів: приплив крові по кровоносних судинах, що оточують секреторні відділи; слинні залози навіть у стані спокою мають високий
Первинна секреція іонів з плазми крові (изотоническая слина)
Мал. 6.1.Транспортні системи в слинних залозах, які беруть участь у формуванні слинного секрету.
об'ємний кровотік. При секреції залоз і відбувається при цьому вазодилятации кровотік зростає в 10-12 разів. Кровоносні капіляри слинних залоз характеризуються високою проникністю, яка в 10 разів вище, ніж в капілярах скелетних м'язів. Ймовірно, що така висока проникність обумовлена наявністю в клітинах слинних залоз активного калликреина, який розщеплює кининогена. Утворені кініни (каллидин і брадикінін) змінюють проникність судин; ток води і іонів по навколо-простору, відкриття
каналів на базолатеральной і апикальной мембранах; скорочення міоепітеліальних клітин, розташованих навколо
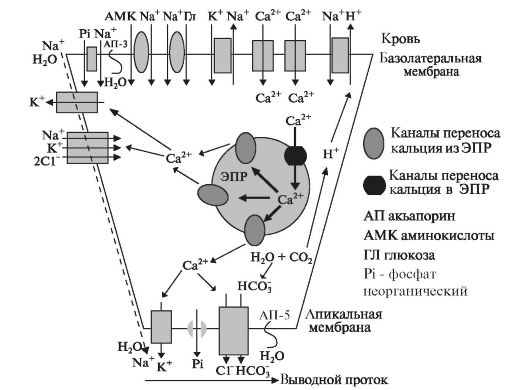
секреторних відділів і вивідних проток. У секреторних клітинах підвищення концентрації іонів Ca 2+ супроводжуєтьсядається відкриттям кальцій-залежних іонних каналів. Синхронне утворення секрету в ацинарних клітинах і скорочення міоепітеліальних клітин призводить до звільнення первинної слини в вивідні протоки. Секреція електролітів і води в секреторних клітинах.Електролітний склад слини і її обсяг визначається діяльністю ацінарних клітин і клітин проток. Транспорт електролітів в ацинарних клітинах складається з двох етапів: перенесення іонів і води через базолатеральную мембрану в клітину і їх вихід через апикальную мембрану в просвіт проток. У клітинах вивідних проток здійснюється не тільки секреція, а й реабсорбція води і електролітів. Транспорт води та іонів відбувається також і в навколо-просторі за механізмом активного і пасивного транспорту.
Через базолатеральную мембрану всередину клітини надходять іони Ca 2+, Cl -, K +, Na +, PO 4 3-, а також глюкоза і амінокислоти. Надалі останні використовуються для синтезу секреторних білків. Молекула глюкози піддається аеробному розпаду до кінцевих продуктів СО 2 і Н 2 О з утворенням молекул АТФ. Велика частина молекул АТФ використовується для роботи транспортних систем. За участю карбоангідрази молекули СО 2 і Н 2 О утворюють вугільну кислоту, яка дисоціює на Н + і НСО 3 -. Поступив в клітку ортофосфат йде на освіту молекул АТФ, а надлишок виділяється через апикальную мембрану за допомогою білка-переносника.
Підвищення концентрації іонів Cl -, Na + всередині клітини викликає приплив води у клітину, яка надходить через білки - аквапоріни. Аквапоріни забезпечують швидкий транспорт рідини через мембрани клітин епітелію і ендотелію. У ссавців ідентифіковано
11 членів сімейства аквапорінов з клітинним і субклітинних розподілом. Частина аквапорінов є білками мембранних каналів і присутні у вигляді тетрамеров. У ряді випадках аквапоріни знаходяться у внутрішньоклітинних везикулах і переносяться в мембрану в результаті стимуляції вазопресином, мускарином (аквапорінов-5). Аквапоріни -0, -1, -2, -4, -5, -8, -10 вибірково пропускають воду; аквапоріни -3, -7, -9 не тільки воду, а й гліцерин і сечовину, а аквапорінов-6 - нітрати.
У слинних залозах аквапорінов-1 локалізована в ендотеліальних клітинах капілярів, а аквапорінов-3 присутня в базолатеральной мембрані ацинарних клітин. Приплив води в ацинарну клітку призводить до інтеграції в апикальную плазматическую мембрану білка аквапорінов-5, що забезпечує вихід води з клітини в слинної протока. Одночасно іони Ca 2+ активують іонні канали в апікальній мембрані, і таким чином витік води з клітини супроводжується виходом іонів в вивідні протоки. Частина води і іонів надходять до складу первинної слини по навколо-простору. Новоутворена первинна слина Ізотонічність плазмі крові і близька до неї за складом електролітів (рис. 6.2).
Мал. 6.2.Клітинні механізми транспорту іонів в ацинарних клітинах.
Біосинтез білкового секрету . В ацинарних клітинах і клітинах вивідних проток слинних залоз здійснюється біосинтез білкового секрету. Амінокислоти надходять в клітину за допомогою натрійзавісімих мембранних транспортерів. Синтез секреторних білків відбувається на рибосомах.
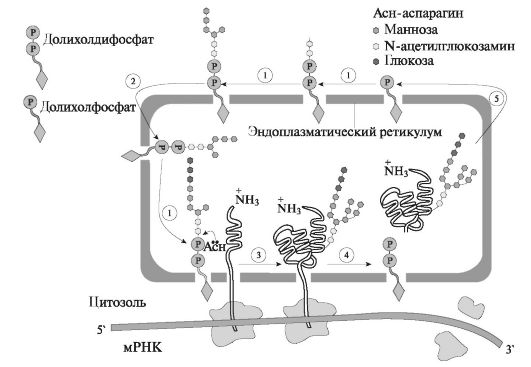
Рибосоми, пов'язані з ендоплазматичної мережею, синтезують білки, які потім глікозіліруются. Перенесення олигосахаридов на зростаючу поліпептидний ланцюг відбувається на внутрішній стороні мембрани ендоплазматичної мережі. Переносниками ліпідів служить доліхолфосфат - ліпід, що містить близько 20 ізопренових залишків. До доліхолфосфатам приєднуються олігосахарідним блок, що складається з 2 залишків N-ацетилглюкозамін, 9 залишків манози і 3 залишків глюкози. Його утворення йде шляхом послідовного приєднання вуглеводів з УДФ- і ГДФ - похідних. У перенесенні беруть участь специфічні глікозілтрансферази. Потім вуглеводний компонент цілком переноситься на певний залишок аспарагіну зростаючої поліпептидного ланцюга. У більшості випадків 2 з 3 залишків глюкози приєднаного олігосахариду швидко віддаляється, коли глікопротеїн ще пов'язаний з ендоплазматичної мережею. При перенесенні олігосахариду на білок вивільняється доліхолдіфосфат, який під дією фосфатази перетворюється в доліхолфосфат. Синтезується початковий продукт накопичується в щілинах і лакунах ендоплазматичноїмережі, звідки переміщається в комплекс Гольджі, де закінчується дозрівання секрету і упаковка гликопротеинов в везикули (рис. 6.3).
У переміщенні і виведенні секрету з клітини беруть участь фібрилярні білки і білок сінексін. Новоутворена секреторна гранула стикається з мембраною і утворюється щільний контакт. Далі на плазмолемме виникають межмембранное глобули і формуються «гібридні» мембрани. У мембрані утворюються отвори, через які вміст секреторних гранул переходить в позаклітинний простір ацинуса. Матеріал мембран секреторних гранул потім використовується для побудови мембран органел клітини.
В апараті Гольджі мукоцитов піднижньощелепної і під'язикової слинних залоз синтезуються глікопротеїни, що містять велику кількість сіалових кислот, аминосахаров, які здатні зв'язувати воду з утворенням слизу. Для цих клітин характерно менш виражена плазматична мережу і виражений апарат
Мал. 6.3.Біосинтез гликопротеинов слинних залоз [по Voet D., Voet J.G., 2004, с змінами].
1 - освіту олігосахарідним ядра в молекулі доліхолфосфата за участю глікозилтрансфераз; 2 - переміщення доліхолфосфата, що містить олігосахарид, у внутрішню порожнину ЕПР; 3 - перенесення олігосахарідним ядра на залишок аспарагіну зростаючої поліпептидного ланцюга; 4 - звільнення доліхолдіфосфата; 5 - рециклізація доліхолфосфата.
Гольджі. Синтезовані глікопротеїни оформляються в секреторні гранули, які виділяються в просвіт вивідних проток.
Формування слини в вивідних протоках
ПРОТОКОВІЙ клітини синтезують і містять біологічно активні речовини, які виводяться в апикальном і базолатеральную напрямках. Клітини проток не тільки утворюють стінки виводя- щих каналів, але і регулюють водний і мінеральний склад слини.
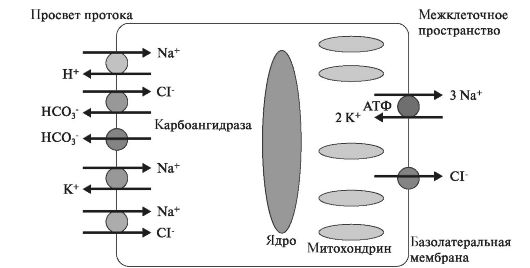
З просвіту вивідних проток, де проходить Ізотонічність слина, відбувається реабсорбція в клітці іонів Na + і Cl -. У клітинах покреслених проток, де є велика кількість мітохондрій, обра-
Мал. 6.4.Формування слини в смугастих клітинах вивідних проток слинних залоз.
-зуется безліч молекул СО 2 і Н 2 О. За участю карбоангідрази вугільна кислота дисоціює на Н + і НСО 3 -. Потім іони H + виводяться в обмін на іони Na +, а НСО 3 - - на Cl -. На базолатеральной мембрані локалізуються транспортні білки Na + / K + АТФ-аза і Cl - - канал, через які іони Na + і Cl - надходять з клітки в кров (рис. 6.4).
Процес реабсорбції регулюється альдостероном. Струм води в вивідних протоках забезпечується білками-аквапорінов. В результаті формується гіпотонічно слина, в якій міститься велика кількість іонів НСО 3 -, К + і мало Na + і Cl -.
В ході секреції з клітин вивідних проток крім іонів секретируются різні білки, синтезовані також в цих клітинах. Надійшли секрети з малих і великих слинних залоз змішуються з клітинними елементами (лейкоцити, мікроорганізми, слущенний епітелій), залишками їжі, метаболітами мікроорганізмів, що призводить до формування змішаної слини, яку також називають ротовою рідиною.
6.3. РЕГУЛЮВАННЯ слиновиділення
Центр слиновиділення, локалізована в довгастому мозку і контролюється супрабульбарнимі відділами головного мозку, включаючи
ядра гіпоталамуса і кору великого мозку. Центр слиновиділення гальмується або стимулюється за принципом безумовних і умовних рефлексів.
Безумовними стимуляторами слиновиділення при прийомі їжі виступають роздратування 5 типів рецепторів в порожнині рота: смакових, температурних, тактильних, больових, нюхових.
Варіювання складу і кількості слини досягається зміною збудливості, числа і виду порушених нейронів центром слиновиділення і відповідно числа і виду ініційованих клітин слинних залоз. Обсяг слиновиділення визначається в основному порушенням М-холінергічних нейронів, що підсилюють синтез і виділення секрету ацинарних клітинами, їх кровопостачанням і виведення секрету в систему проток скороченнями міоепітеліальних клітин.
Міоепітеліальние клітини прикріплюються за допомогою полудесмосом до базальної мембрані і містять в цитоплазмі білки-цито- кератину, гладко-м'язові актину, міозину, а-актініни. Від тіла клітини відходять відростки, що охоплюють епітеліальні клітини залоз. Скорочуючи, міоепітеліальние клітини сприяють просуванню секрету з кінцевих відділів по вивідним протоках залоз.
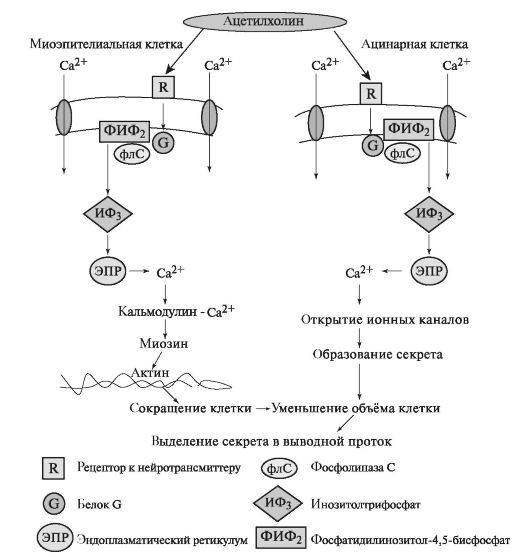
Ацетилхолін в міоепітеліальних і ацинарних клітинах пов'язується з рецептором, і через G-білок активує фосфоліпазу С. Фосфоліпаза З гидролизует фосфатидилинозитол - 4,5-бісфосфат, і утворюється інозітолтріфосфат підвищує концентрацію іонів Ca 2+ всередині клітини. Іони Ca 2+, що надходять з депо, зв'язуються з білком кальмодулином. У міоепітеліальних клітинах активована кальцієм киназа фосфорилирует легкі ланцюги гладеньком'язового міозину, який взаємодіє з актином, що викликає їх скорочення (рис. 6.5). Особливістю гладком'язових тканини є досить низька активність АТФази міозину, тому повільне утворення і руйнування актин-миозинових містків вимагають меншої кількості АТФ. У зв'язку з цим скорочення викликається повільно і підтримується тривалий час.
Слиновиділення також регулюється симпатичної іннервації, гормонами і нейропептидами. Звільняються нейротрансмітери - адреналін і норадреналін зв'язуються зі специфічними адренорецепторами на базолатеральной мембрані ацинарной клітини. Утворився комплекс передає сигнали через G-білки. Активована аденилатциклаза каталізує перетворення молекули
Мал. 6.5.Роль ацетилхоліну в освіті і виділенні секрету в секреторних відділах слинних залоз.
АТФ в другій посередник 3 ", 5" цАМФ, що супроводжується активацією протеїнкінази А з подальшим синтезом білків і їх екзоцитозу з клітини. Після зв'язування адреналіну з а-адренорецепторами утворюється молекула 1,4,5-інозітолтріфосфат, що супроводжується мобілізацією Са 2+ і відкриттям кальційзалежних каналів з пос
ледующей секрецією рідини. За час секреції клітини втрачають іони Са 2+, що супроводжується зміною проникності мембран в залізистих клітинах.
Крім нейротрансмітерів (адреналін, норадреналін і ацетилхолін) в регуляції тонусу судин слинних залоз важливу роль відіграють нейропептиди: речовина P, яка є медіатором підвищення проникності для білків плазми крові і вазоактивний кишковий (інтестінальний) поліпептид (ВІП), який бере участь в нехолінергіческом розширенні судин.
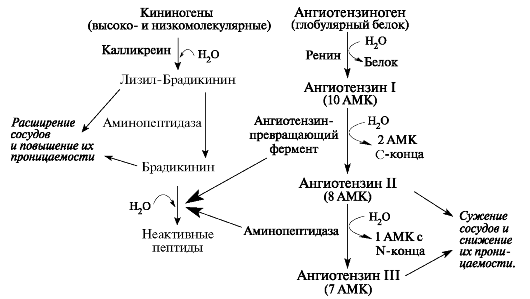
На кровотік і підвищення проникності судин також впливають і активні пептиди каллидин і брадикінін. В освіті кининов бере участь серинові тріпсіноподобних протеиназа - калликреин,виробляється клітинами покреслених проток. Калікреїн викликає обмежений протеоліз глобулярних білків кининогенов з утворенням біологічно активних пептидів - кінінів. Брадикинин зв'язується з рецепторами В1 і В2, що призводить до мобі- лізації внутрішньоклітинного кальцію з наступним активированием протеїнкінази С, яка запускає каскад передачі сигналу всередині клітини через оксид азоту, цГМФ, простагландини. Освіта цих вторинних посередників в ендотеліальних і гладко-м'язових клітинах забезпечує розширення судин слинних залоз і слизових оболонок. Це призводить до гіперемії, підвищення проникності судин, зниження артеріального тиску. Синтез калликреина збільшується під впливом андрогенів, тироксину, простагландину, холіноміметіков і (3-адреноміметиків.
У регуляції судинного тонусу також бере участь аспартільная протеиназа - ренін.Ренін концентрується в гранулярних звивистих протоках піднижньощелепних залоз, де він локалізується в сек- реторних гранулах разом з фактором росту епітелію. У слинних залозах реніну синтезується більше, ніж в нирках. Фермент містить дві поліпептидні ланцюги, об'єднані дисульфідній зв'язком. Виділяється у вигляді препрореніна і активується шляхом обмеженого протеолізу.
Під дією реніну відбувається розщеплення ангіотензиногена і звільняється пептид ангіотензин I. Подальший гідроліз ангі-
отензіна I ангіотензинперетворюючого ферменту з відщепленням двох амінокислотних залишків, призводить до утворення ангіотен- зина II, який викликає звуження периферичних артерій, регулює водно-сольовий обмін і може впливати на секреторну функцію слинних залоз (рис. 6.6).
Мал. 6.6.Схема взаємозв'язку ренінангіотензинової і калікреїн-кінінової систем на поверхні судинного ендотелію в слинних залозах.
Одночасно ангиотензинпревращающий фермент і амінопептидази виступають в якості кініназу, що розщеплюють активні кініни.
6.4. змішана СЛИНА
Змішана слина (ротова рідина) являє собою в'язку (в зв'язку з присутністю гликопротеинов) рідина з відносною щільністю 1001-1017. Коливання рН слини залежать від гігіенічес- кого стану порожнини рота, характеру їжі, швидкості секреції. При низькій швидкості секреції рН слини зсувається в кислу сторону, при стимуляції слиновиділення - в лужну.
Функції змішаної слини
травна функція . Змочуючи і розм'якшуючи тверду їжу, слина забезпечує формування харчової грудки і полегшує
проковтування їжі. Після просочування слиною харчові компоненти в порожнині рота піддаються частковому гідролізу. Вуглеводи розщеплюються а-амілазою до декстринів і мальтози, а триацилгліцеролів до гліцерину і жирних кислот липазой, що виділяється слинними залозами, розташованими в корені мови. Розчинення в слині хімічних речовин, що входять до складу їжі, сприяє сприйняттю смаку смаковим аналізатором.
Комунікативна функція. Слина необхідна для формування правильної мови і спілкування. При постійному потоці повітря в процесі розмови, прийому їжі зберігається вологість в порожнині рота (муцин і інші глікопротеїни слини).
Захисна функція . Слина очищає зуби і слизову оболонку порожнини рота від бактерій і продуктів їх метаболізму, залишків їжі. Захисну функцію здійснюють різні білки - іммуногло- Булинь, гістатіни, α- і (3-дефензіни, кателідін, лізоцим, лакто Феррін, муцин, інгібітори протеолітичних ферментів, фактори росту та інші глікопротеїни.
Мінераліз функція . Слина - основне джерело кальцію і фосфору для емалі зуба. Вони надходять через придбану пелликулу, яка формується з білків слини (статзерін, білки багаті пролином і ін.) І регулює як надходження мінеральних іонів в емаль зуба, так і вихід їх з неї.
Склад змішаної слини
Змішана слина складається з 98,5-99,5% води і сухого залишку (табл. 6.1). Сухий залишок представлений неорганічними речовинами і органічними сполуками. Щодня у людини виділяється близько 1000-1200 мл слини. Активність секреції і хімічний склад слини схильні до значних коливань.
Хімічний склад слини схильний добовим коливанням (циркадні ритми). Швидкість слиновиділення коливається в широких межах (0,03-2,4 мл / хв) і залежить від великої кількості факторів. Під час сну швидкість секреції знижується до 0,05 мл / хв, вранці зростає в кілька разів і досягає верхньої межі в 12-14 годин, до 18-ї години вона знижується. У людей з низькою секреторною активністю значно частіше розвивається карієс, тому зменшення кількості слини в нічний час сприяє прояву дії каріесогенних факторів. Склад слини і секреція також залежать від віку і статі. У літніх людей, наприклад, значно повишает-
Таблиця 6.1
Хімічний склад змішаної слини
ся кількість кальцію, що має значення для утворення зубного і слинного каменю. Зміни в складі слини можуть бути пов'язані з прийомом лікарських речовин, інтоксикацією і захворюваннями. Так, при зневодненні організму, цукровому діабеті, уремії відбувається різке зниження слиновиділення.
Властивості змішаної слини міняються в залежності від характеру збудника секреції (наприклад, вид прийнятої їжі), швидкості секреції. Так, при вживанні в їжу печива, цукерок в змішаній слині тимчасово зростає рівень глюкози і лактату. При стимуляції слиновиділення кількість відокремлюваної слини збільшується, в ній зростає концентрація іонів Na + і HCO 3 -.
неорганічні компоненти , Що входять до складу слини, представлені аніонами Cl -, PO 4 3-, HCO 3 -, SCN -, I -, Br -, F -, SO 4 2-, катионами Na +, К +, Ca 2+, Mg 2 + і мікроелементами: Fe, Cu, Mn, Ni, Li, Zn, Cd, Pb, Li і ін. Всі мінеральні макро- і мікроелементи знаходяться як у вигляді простих іонів, так і в складі з'єднань - солей, білків і хелатів (табл . 6.2).
Аніони HCO 3 - виводиться за допомогою активного транспорту з привушної і піднижньощелепної слинних залоз і визначає буферну ємність слини. Концентрація HCO 3 - слини «спокою» становить 5 ммоль / л, а в стимульованої слині 60 ммоль / л.
Таблиця 6.2
Неорганічні компоненти нестимульований змішаної слини
і плазми крові
речовина | Слина, моль / л | Плазма крові, моль / л |
натрій | 6,6-24,0 | 130-150 |
калій | 12,0-25,0 | 3,6-5,0 |
хлор | 11,0-20,0 | 97,0-108,0 |
Загальний кальцій | 0,75-3,0 | 2,1-2,8 |
неорганічний фосфат | 2,2-6,5 | 1,0-1,6 |
Загальний фосфат | 3,0-7,0 | 3,0-5,0 |
гідрокарбонат | 20,0-60,0 | 25,0 |
тіоціанат | 0,5-1,2 | 0,1-0,2 |
мідь | ||
йод | 0,01 |
|
фтор | 0,001-0,15 | 0,15 |
У змішану слину іони Na + і К + надходять з секретом привушних і підщелепних слинних залоз. Слина з підщелепних слинних залоз містить 8-14 ммоль / л калію і 6-12 ммоль / л натрію. Паротідная слина містить ще більшу кількість калію - близько 25-49 ммоль / л і значно менше натрію - всього 2-8 ммоль / л.
Слина перенасичена іонами фосфору та кальцію. Фосфат міститься в двох формах: у вигляді «неорганічного» фосфату і пов'язаного з білками і іншими сполуками. Зміст загального фосфату в слині досягає 7,0 ммоль / л, з них 70-95% припадає на частку неорганічного фосфату (2,2-6,5 ммоль / л), який представлений у вигляді моногідрофосфата - НРO 4 - і дигідрофосфату - Н 2 РО 4 -. Концентрація моногідрофосфата змінюється від рівня нижче 1 ммоль / л в слині «спокою» до 3 ммоль / л в стимульованої слині. Концентрація дигидрофосфата слини «спокою» досягає 7,8 ммоль / л, а в стимульованої слині його стає менше 1 ммоль / л.
Така концентрація кальцію і фосфатів необхідна для підтримання сталості тканин зуба. Цей механізм протікає через три основні процеси: регуляцію рН; перешкода в розчиненні емалі зуба; включення іонів в мінералізовані тканини.
Збільшення в плазмі крові до нефизиологических величин іонів важких металів супроводжується їх виведенням через слинні залози. Надійшли зі слиною в ротову порожнину іони важких металів взаємодіють з виділеними мікроорганізмами молекулами сірководню і утворюються сульфіди металів. Так з'являється «свинцева облямівка» на поверхні емалі зубів.
При руйнуванні сечовини уреазой мікроорганізмів в змішану слину звільняється молекула аміаку (NH 3). Тіоцінати (SCN -, роданіди) надходять в слину з плазми крові. Тіоціаніти утворюються з синильної кислоти за участю ферменту роданези. У слині курців міститься в 4-10 разів більше роданидов, ніж у некурящих. Їх кількість також може зростати при запаленні пародонта. При розпаді йодтиронінів в слинних залозах звільняються іодіди. Кількість иодидов і тіоціанатів залежить від швидкості слиновиділення і знижується при збільшенні секреції слини.
Органічні речовини представлені білками, пептидами, амінокислотами, вуглеводами і в основному присутні в осаді змішаної слини, сформованого мікроорганізмами, лейкоцитами і злущеними клітинами епітелію (табл. 6.3). Лейкоцити поглинають компоненти харчових речовин, що надходять в ротову порожнину, і метаболіти, що утворюються звільняються в навколишнє середовище. Інша частина органічних речовин - сечовина, креатинін, гормони, пептиди, фактори росту, калікреїн та інші ферменти - ескретіруется з секретом слинних залоз.
ліпіди. Загальна кількість ліпідів в слині не постійно і не перевищує 60-70 мг / л. Велика їх частина надходить в ротову порожнину з секретами привушних і піднижньощелепних слинних залоз, і тільки 2% з плазми крові і клітин. Частина слинних ліпідів представлена вільними довголанцюгових насиченими і поліненасиченими жирними кислотами - пальмітинової, стеаринової, ейкозопентаеновой, олеїнової та ін. Крім жирних кислот в слині визначаються вільний холестерин і його ефіри (близько 28% від загальної кількості), триацилгліцеролів (близько 40-50%) і в дуже невеликій кількості гліцерофосфоліпіди. Слід зазначити, що дані про зміст і характер ліпідів в слині неоднозначні.
Таблиця 6.3
Органічні компоненти змішаної слини
речовини | Од. виміру |
білок | 1,0-3,0 г / л |
альбумін | 30,0 мг / л |
імуноглобулін А | 39,0-59,0 мг / л |
імуноглобулін G | 11,0-18,0 мг / л |
імуноглобулін М | 2,3-4,8 мг / л |
Молочна кислота | 33,0 мг / л |
піровиноградна кислота | 9,0 мг / л |
гексозаміни | 100,0 мг / л |
фукоза | 90,0 мг / л |
нейрамінової кислота | 12 мг / л |
загальні гексози | 195,0 мг / л |
глюкоза | 0,06-0,17 ммоль / л |
сечовина | 200,0 мг / л |
холестерин | 80,0 мг / л |
Сечова кислота | 0,18 ммоль / л |
креатинін | 2,0-10,0 мкмоль / л |
Це пов'язано в першу чергу з методами очищення і виділення ліпідів, а також способом отримання слини, віком обстежуваних і іншими факторами.
сечовинав порожнину рота ескретіруется слинні залози. Найбільше її кількість виділяється малими слинними залозами, потім привушні і піднижньощелепної. Кількість виділеної сечовини залежить від швидкості слиновиділення і обернено пропорційно кількості виділеної слини. Відомо, що рівень сечовини в слині підвищується при захворюваннях нирок. У порожнині рота сечовина розщеплюється за участю уреолітіческіх бактерій осаду слини:
Кількість звільняється NH 3 впливає на рН зубної бляшки і змішаної слини.
Крім сечовини в слині визначається сечова кислота, Зміст якої (до 0,18 ммоль / л) відображає її концентрацію в сироватці крові.
У слині також присутній креатинін в кількості 2,0-10,0 мкмоль / л. Всі ці речовини визначають рівень залишкового азоту в слині.
Органічні кислоти. Слина містить лактат, піруват і інші органічні кислоти, нітрати і нітрити. В осаді слини міститься в 2-4 рази більше лактату, ніж в рідкої її частини, в той час як піруват визначається більше в надосадової рідини. Збільшення вмісту органічних кислот, зокрема, лактату в слині, і зубному нальоті сприяє осередкової демінералізації емалі і розвитку карієсу.
нітрати(NО з -) і нітрити(О 2 -) надходять в слину з їжею, тютюновим димом і водою. Нітрати за участю нітратредуктази бактерій перетворюються в нітрити і їх зміст залежить від куріння. Показано, що у курців та осіб, зайнятих в тютюновому виробництві, розвивається лейкоплакія слизової оболонки порожнини рота, а в слині зростає активність нітратредуктази і кількість нітритів. Утворилися нітрити, в свою чергу, можуть вступити в реакцію з вторинними амінами (амінокислоти, ліки) з утворенням канцерогенних нитрозосоединений. Ця реакція протікає в кислому середовищі, а прискорюють її додані в реакцію тіоціанати, кількість яких в слині також зростає при курінні.
вуглеводив слині знаходяться переважно в зв'язаному з біл- ками стані. Вільні вуглеводи з'являються після гідролізу полісахаридів і глікопротеїнів глікозідазамі бактерій слини і α-амілазою. Однак утворилися моносахара (глюкоза, галактоза, маноза, гексозаміни) і сіалові кислоти швидко утилізуються мікрофлорою ротової порожнини і перетворюються в органічні кислоти. Частина глюкози може надходити з секретами слинних залоз і відображати її концентрацію в плазмі крові. Кількість глюкози в змішаній слині не перевищує 0,06-0,17 ммоль / л. Визначення глюкози в слині слід проводити глюкозоксідазним методом, оскільки присутність інших редукуючих речовин значно спотворює дійсні значення.
Гормони.У слині визначається цілий ряд гормонів, в основному стероидной природи. У слину вони потрапляють з плазми крові через слинні залози, десневую рідина, а також при прийомі гормонів per os. У слині виявлено кортизол, альдостерон, тестостерон, естроген і прогестерон, а також їх метаболіти. Вони знаходяться в слині переважно у вільному стані, і тільки в невеликих кількостях в комплексі зі зв'язуючими білками. кількість
андрогенів і естрогенів залежить від ступеня статевого дозрівання і може змінюватися при патології репродуктивної системи. Рівень прогестерону і естрогену в слині, як і в плазмі крові, змінюється в різні фази менструального циклу. У нормі в слині також присутні інсулін, вільний тироксин, тиреотропин, кальцитріол. Концентрація цих гормонів в слині невелика і не завжди корелює з показниками плазми крові.
Регуляція кислотно-основного стану рота
Епітелій порожнини рота піддається всіляким і фізичним, і хімічних впливів, пов'язаних з вживанням їжі. Слина здатна захистити епітелій верхньої частини травного тракту, а також емаль зуба. Однією з форм захисту є збереження і підтримання рН-середовища в ротовій порожнині.
Оскільки змішана слина являє собою суспензію клітин рідкого середовища, яка омиває зубний ряд, то кислотно-лужний стан порожнини рота визначається швидкістю слиновиділення, спільною дією буферних систем слини, а також метаболітами мікроорганізмів, кількістю зубів і частотою їх розташування в зубній дузі. Значення рН змішаної слини в нормі коливається від 6,5 до 7,4 з середньою величиною близько 7,0.
Буферними системами називають такі розчини, які здатні зберігати сталість рН-середовища при їх розведенні або добавкою лении невеликої кількості кислот, підстав. Зменшення рН називають ацидозом, а збільшення - алкалозом.
Змішана слина містить три буферних системи: гідрокарбонатну, фосфатнуі білкову.Разом ці буферні системи формують першу лінію захисту проти кислотних або лужних впливів на тканини порожнини рота. Все буферні системи порожнини рота мають різні межі ємності: фосфатная найбільш активна при рН 6,8-7,0, гідрокарбонатна при рН 6,1-6,3, а білкова забезпечує буферну ємність при різних значеннях рН.
Основний буферної системою слини є гідрокарбонатна , яка являє собою пов'язану кислотно-основну пару, що складається з молекули H 2 CO 3 - донора протона, і гідрокарбонатіона НСО 3 - акцептора протона.
Під час прийому їжі, жування буферна ємність гідрокарбонатної системи забезпечується на основі рівноваги: СО 2 + Н 2 О = НСО 3 + Н +. Жування супроводжується підвищенням слиновиділення, що призводить до уве-
личен концентрації гідрокарбонату в слині. При додаванні кислоти фаза переходу СО 2 з розчиненого газу у вільний (летючий) газ значно зростає і збільшує ефективність нейтралізують реакцій. В силу того, що кінцеві продукти реакцій не накопичуються, відбувається повне видалення кислот. Цей феномен отримав назву «буфер-фаза».
При тривалому стоянні слини відбувається втрата СО 2. Е та особливість гідрокарбонатної системи називається стадією буферизації, і вона триває до тих пір, поки не витратиться більше 50% гідрокарбонату.
Після впливу кислот і лугів H 2 CO 3 швидко розпадається до CO 2 і H 2 O. Дисоціація молекул вугільної кислоти відбувається в дві стадії:
H 2 CO 3 + H 2 O<---> HCO 3 - + H 3 O + HCO 3 - + H 2 O<---> CO 3 2- + H 3 O +
Фосфатна буферна система слини є сопряжён- ву кислотно-основну пару, що складається з іона дигідрофосфату H 2 PO 2 (донор протона) і іона моногідрофосфата - HPO 4 3- (а до ц е п т о р протона). Фосфатна система менш ефективна в порівнянні з гідро- карбонатної і не має ефекту «буфер-фази». Концентрація HPO 4 3 в слині не визначається швидкістю слиновиділення, тому ємність фосфатной буферної системи не залежить від прийому їжі або жування.
Реакції компонентів фосфатної буферної системи з кислотами і підставами відбуваються наступним чином:
При додаванні кислоти: HPO 4 3- + H 3 O +<---> H 2 PO 2 + H 2 O
При додаванні підстави: H 2 PO 2 + ОН -<---> HPO 4 3- + H 2 O
Білкова буферна система має спорідненість до біологічних процесів, що протікають в порожнині рота. Вона представлена аніонними і катіонними білками, які добре розчиняються у воді. Ця буферна система включає більш 944 різних білків, але до кінця не відомо, які саме білки беруть участь в регуляції кислотно-лужної рівноваги. Карбоксильні групи радикалів аспартату, глутамату, а також радикали цистеїну, серину і тирозину є донорами протонів:
R-CH 2 -COOH<---> R-CH 2 -COO - + H + (Аспартат);
R- (CH 2) 2 -COOH<---> R-CH 2 -COO - + H + (Глутамат).
Аміногрупи радикалів амінокислот гістидину, лізину, аргініну здатні приєднувати протони:
R- (CH 2) 4 -NH 2 + H +<---> R- (CH 2) 4 (-N H +) (Лізин)
R- (CH 2) 3 -NH-C (= NH) -NH 2) + H +<---> (R- (CH 2) 3 -NH-C (= NH 2 +) - NH)
(Аргінін)
У зв'язку з цим білкова буферна система ефективна як при pH 8,1, так і pH 5,1.
рН слини «спокою» відрізняється від рН стимульованої слини. Так, нестимульований секрет з паротідной і піднижньощелепної слинних залоз має помірно кислий рН (5,8), який збільшується до 7,4 при подальшій стимуляція. Цей зсув збігається зі збільшенням в слині кількості НСО 3 - до 60 ммоль / л.
Завдяки буферним системам у практично здорових людей рівень pH змішаної слини відновлюється після їжі до результат- ного значення протягом декількох хвилин. При неспроможності буферних систем pH змішаної слини знижується, що супроводжується збільшенням швидкості демінералізації емалі і ініціює розвиток каріозного процесу.
На pH слини в великій мірі впливає характер їжі: при пріё- ме апельсинового соку, кави з цукром, полуничного йогурту pH знижується до 3,8-5,5, в той час як вживання пива, кави без цукру практично не викликають зрушень pH слини .
Структурна організація мицелл слини
Чому ж кальцій і фосфати не випадають в осад? Це обумовлено тим, що слина є колоїдної системою, що містить агрегати досить малих нерозчинних у воді часток (0,1-100 нм), що знаходяться в підвішеному стані. У колоїдної системі закладено дві проти- положную тенденції: її нестійкість і прагнення до самоупроченію, стабілізації. Сумарна величина великий поверхні колоїдних частинок різко збільшує її здатність поглинати поверхневим шаром інші речовини, що підвищує стійкість цих частинок. У разі органічних колоїдів поряд з електролітами, які є іонними стабілізаторами, стабілізуючу роль виконують білки.
Речовина, що знаходиться в дисперсному стані, утворює нерозчинний «ядро» колоїдної ступеня дисперсності. Воно вступає в
адсорбційна взаємодія з іонами електроліту (стабілізатор), що знаходиться в рідкій (водна) фазі. Молекули стабілізатора диссоциируют в воді і беруть участь в утворенні подвійного електричного шару навколо ядра (адсорбційний шар) і дифузного шару навколо такої зарядженої частинки. Весь комплекс, що складається з нерозчинного у воді ядра, дисперсної фази і шарів стабілізатора (дифузний і адсорбційний), що охоплюють ядро, отримав назву міцели .
Яка ж ймовірна структурна організація мицелл в слині? Припускають, що нерозчинний ядро міцели утворює фосфат кальцію [Са 3 (РO 4) 2] (рис. 6.7). На поверхні ядра сорбируются знаходяться в слині в надлишку молекули моногідрофосфата (НРO 4 2). У адсорбционном і дифузних шарах міцели знаходяться іони Са 2+, є противоионами. Білки (зокрема муцин), що зв'язують велику кількість води, сприяють розподілу всього обсягу слини між мицеллами, в результаті чого вона структурується, набуває високу в'язкість, стає малорухомої.
Умовні позначення
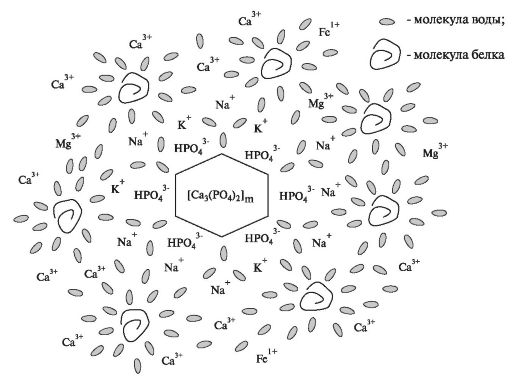
Мал. 6.7.Передбачувана модель будови міцели слини з «ядром» з фосфату кальцію.
У кислому середовищі заряд міцели може зменшитися вдвічі, так як іони моногідрофосфата пов'язують протони H +. З'являються іони дигидрофосфата - Н 2 РО 4 - замість моногідрофосфата НРO 4 -. Це знижує стійкість міцели, а іони дигидрофосфата такий міцели не беруть участі в процесі ремінералізації емалі. Подщелачивание призводить до збільшення фосфат-іонів, які з'єднуються з Ca 2+ і утворюються погано розчинні сполуки Са 3 (РO 4) 2, що осідають у вигляді зубного каменю.
Зміна структури мицелл слині також призводить до утворення каменів у протоках слинних залоз і розвитку слюннокаменной хвороби.
Мікрокрісталлізація слини
П.А. Леус (1977) вперше показав, що на предметному склі після висушування краплі слини формуються структури, що мають роз- приватне будова. Встановлено, що характер мікрокристалів слини має індивідуальні особливості, які можуть бути пов'язані зі станом організму, тканин порожнини рота, характером харчування і екологічною обстановкою.
При висушуванні слини здорової людини під мікроскопом видно мікрокристали, що мають характерний малюнок сформованих «листя папороті» або «коралових гілок» (рис. 6.8).
Існує певна залежність виду малюнка від ступеня в'язкості слини. При низькій в'язкості мікрокристали представлені дрібними, безформними, розсіяними, рідко розташованими утвореннями без чіткої структури. У них включаються окремі ділянки у вигляді тонких, слабо виражених «листя папороті» (рис. 6.9, А). Навпаки, при високій в'язкості змішаної слини мікрокристали щільно розташовані і в основному хаотично орієнтовані. Є велика кількість зернистих і ромбовидних структур більш темного кольору в порівнянні з аналогічними утвореннями, які виявляються в змішаній слині з нормальною в'язкістю (рис. 6.9, Б).
Вживання води, насиченої мінералами мають високу електропровідність (коралова вода), нормалізує в'язкість і відновлює структуру рідких кристалів ротової рідини.
Характер малюнка мікрокристалів також змінюється при патології зубощелепної системи. Так для компенсованої форми перебігу карієсу характерний чіткий малюнок подовжених кристал
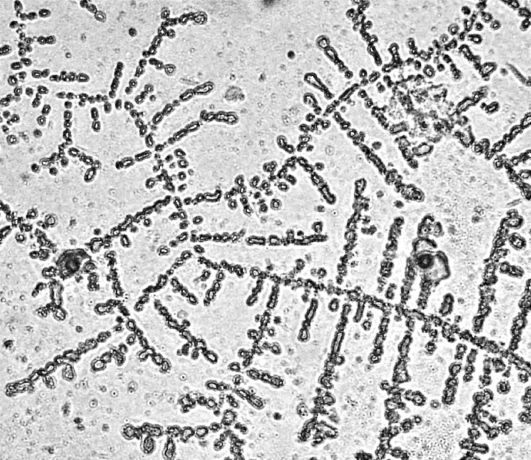
Мал. 6.8.Будова мікрокристалів слини здорової людини.
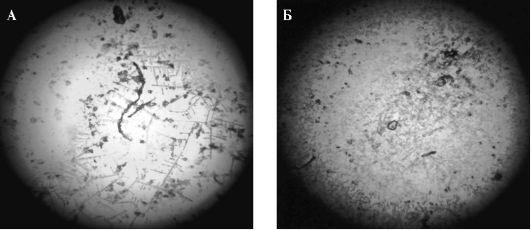
Мал. 6.9.Будова мікрокристалів змішаної слини:
А- слина зниженої в'язкості; Б- слина підвищеної в'язкості.
лопрізматіческіх структур, зрощених між собою і займають всю поверхню краплі. При субкомпенсированной формі перебігу карієсу в центрі краплі видно окремі дендритні крісталлопрізматіческіе структури невеликих розмірів. При декомпенспрованной формі карієсу по всій площі краплі проглядається велика кількість изометрически розташованих кристалічних структур неправильної форми.
З іншого боку, є відомості про те, що мікрокрісталлізація слини відображає стан організму в цілому, тому перед покладається використовувати крісталлообразованія слини як тест-систему для експрес-діагностики деяких соматичних захворювань або загальної оцінки стану організму.
білки слини
В даний час методом двовимірного електрофорезу в змішаній слині виявлено близько 1009 протеїнів, з них 306 ідентифіковано.
Більшість білків слини є глікопротеїнами, в яких кількість вуглеводів досягає 4-40%. Секрети різних слинних залоз містять глікопротеїни в різних пропорціях, що і визначає різницю в їх в'язкості. Так, найбільш в'язка слина - секрет под'- мовній залози (коефіцієнт в'язкості 13,4), потім підщелепної (3,4) і паротідной (1,5). В умовах стимуляції можуть синтезуватися неповноцінні глікопротеїни і слина стає менш в'язкою.
Слинні глікопротеїни неоднорідні і відрізняються по мовляв. масі, рухливості в ізоелектричному поле і змістом фосфату. Олігосахаридні ланцюга в слинних білках зв'язуються з гідроксильною групою серину і треоніну О-гликозидной зв'язком або приєднується до залишку аспарагіну через N-глікозидний зв'язок (рис. 6.10).
Джерелами білків в змішаній слині є:
1. Секрети великих і малих слинних залоз;
2. Клітини - мікроорганізми, лейкоцити, слущенний епітелій;
3. Плазма крові. Білки слини виконують безліч функцій (рис. 6.11). При цьому
один і той же білок може брати участь в декількох процесах, що дозволяє говорити про полифункциональности слинних білків.
секреторні білки . Ряд білків слини синтезуються слинних залоз і представлені муцином (дві ізоформи М-1, М-2), білками, багатими пролином, імуноглобулінами (IgA, IgG, IgM),
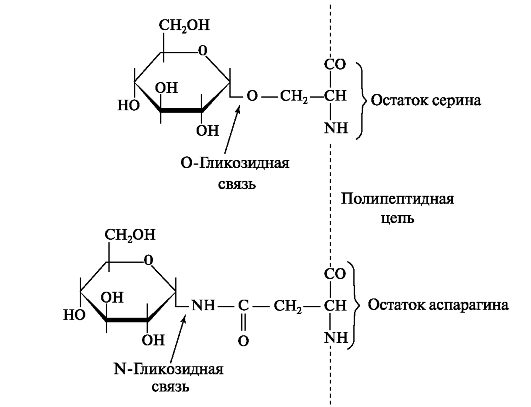
Мал. 6.10.Приєднання моносахаридних залишків в глікопротеїну через О і N- гликозидні зв'язку.
кАЛІКРЕЇН, паротин; ферментами - а-амілазою, лізоцимом, гістатінамі, цістатіна, статзеріном, карбоангидразой, пероксидазою, лактоферрином, протеиназами, липазой, фосфатази та іншими. Вони мають різну мовляв. масу; найбільшою мають муцини і секреторний імуноглобулін А (рис. 6.12). Ці білки слини на слизовій оболонці порожнини рота формують пелликулу, яка забезпечує мастило, захищає слизову від впливу факторів зовнішнього середовища і протеолітичних ферментів, що виділяються бактеріями і зруйнованими поліморфоядерних лейкоцитами, а також запобігає її висушування.
муцини -високомолекулярні білки, що володіють великою кількістю функцій. Виявлено дві ізоформи цього білка, які розрізняються по мовляв. масі: муцин-1 - 250 кДа, муцин-2 - 1000 кДа. Муцин синтезується в піднижньощелепних, під'язикові і малих слинних залозах. У поліпептидного ланцюга муцина міститься велика кількість серину і треоніну, а всього їх налічується близько 200 на
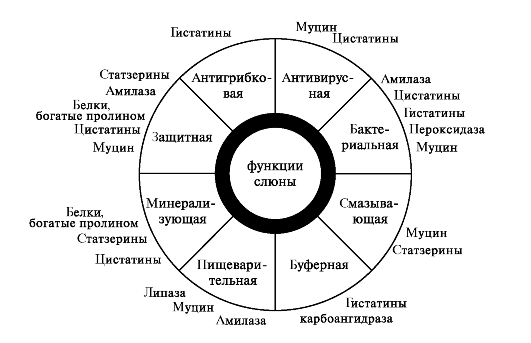
Мал. 6.11.Поліфункціональність білків змішаної слини.
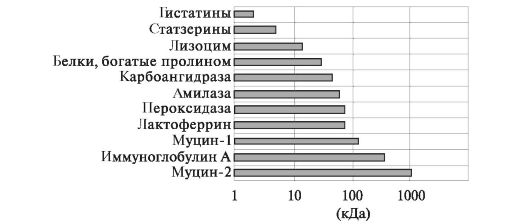
Мал. 6.12.Молекулярний вага деяких основних секреторних білків слини [по Levine М., 1993].
одну поліпептидний ланцюг. Третьою, найбільш часто зустрічається амінокислотою в муцини, є пролін. До залишків серину і треоніну через 0-глікозидний зв'язок приєднані залишки N-ацетил
нейрамінової кислоти, N-ацетілгалактозаміна, фруктози і галактози. Сам білок нагадує за своєю будовою гребінку: короткі вуглеводні ланцюги, як зуби, стирчать з жорсткою, багатою пролином, поліпептидного основи (рис. 6.13).
Завдяки здатності зв'язувати велику кількість води муцини надають слині в'язкість, захищають поверхню від бактеріального забруднення і розчинення фосфату кальцію. Бактеріальна захист забезпечується спільно з імуноглобулінами і деякими іншими білками, приєднаними до муцину. Муцини присутні не тільки в слині, але також в секретах бронхів і кишечника, насінної рідини і виділеннях з шийки матки, де грають роль мастила і захищають підлеглі тканини від хімічних і механічних пошкоджень.
Олігосахариди, пов'язані з муцинами, мають антигенної специфічністю, що відповідає группоспецифических антигенів, які присутні також у вигляді сфинголипидов і глікопротеїнів на поверхні еритроцитів і у вигляді олігосахаридів в молоці і сечі. Здатність секретувати групоспецифічні речовини в складі слини передається у спадок.
Концентрація группоспецифических речовин в слині дорівнює 10 130 мг / л. Вони в основному надходять з секретом малих слинних залоз і точно відповідають групі крові. Дослідження группоспецифических речовин в слині використовується в судовій медицині для уста-
Мал. 6.13.Структура слинного муцина.
лення групи крові в тих випадках, коли це неможливо зробити інакше. У 20% випадків зустрічаються індивідууми, у яких глікопротеїни, що містяться в секретах, позбавлені характерної антигенної специфічності А, В або Н.
Білки, багаті пролином (ББП). Вперше про ці білках в 1971 р повідомив Оппенхеймер. Вони були відкриті в слині привушних залоз і складають до 70% від загальної кількості всіх білків в цьому секреті. Мовляв. маса ББП коливається від 6 до 12 кДа. Дослідження амінокислотного складу виявило, що 75% від загального числа амінокислот припадає на пролін, гліцин, глутамінова і аспарагінову кислоти. Це сімейство об'єднують кілька білків, які за властивостями ділять на 3 групи: кислі ББП; основні ББП; глікозильовані ББП.
ББП виконують в порожнині рота кілька функцій. В першу чергу, вони легко адсорбуються на поверхні емалі і є компонентами придбаної пеллікули зуба. Кислі ББП, що входять до складу пеллікули зуба, зв'язуються з білком статеріном і перешкоджають його взаємодії з гідроксиапатиту при кислих значеннях рН. Таким чином, кислі ББП затримують деминерализацию емалі зуба і інгібують зайве осадження мінералів, тобто підтримують сталість кількості кальцію і фосфору в емалі зуба. Кислі та глікозильовані ББП також здатні зв'язувати певні мікроорганізми і таким чином беруть участь в утворенні мікробних колоній в зубному нальоті. Глікозильовані ББП беруть участь в змочуванні харчової грудки. Припускають, що основні ББП грають певну роль в зв'язуванні танинов їжі і тим самим захищають слизову оболонку порожнини рота від їх шкідливої дії, а також надають в'язко-еластичні властивості слині.
антимікробні пептиди в змішану слину потрапляють з секретом слинних залоз з лейкоцитів і епітелію слизової оболонки. Вони представлені кателідінамі; α - і (3-дефензіни; кальпротектіном; пептидами з високою пропорцією специфічних амінокислот (гістатіни).
Гістатіни(Білки, багаті гистидином). Із секретів привушних і підщелепних слинних залоз людини виділено сімейство основних олиго- і поліпептидів, що відрізняються великим вмістом гістидину. Дослідження первинної структури гістатінов показало, що вони складаються з 7-38 амінокислотних залишків і мають велику ступінь подібності між собою. Сімейство гістатінов представлено 12 пеп-
тидами з різною мовляв. масою. Вважають, що окремі пептиди цього сімейства утворюються в реакціях обмеженого протеолізу, або в секреторних везикулах, або при проходженні білків через залізисті протоки. Гістатіни -1 і -2 значно відрізняються від інших членів цього сімейства білків. Встановлено, що гістатін-2 є фрагментом гістатіна-1, а гістатіни-4-12 утворюються при гідролізі гістатіна-3 за участю ряду протеїназ, зокрема, калікреїну.
Хоча біологічні функції гістатінов остаточно не з'ясовані, вже встановлено, що гістатін-1 бере участь в утворенні придбаної пеллікули зуба і є потужним інгібітором росту кристалів гідроксиапатиту в слині. Суміш очищених гістатінов подавлялает зростання деяких видів стрептококів (Str. Mutans).Гістатін-5 пригнічує дію вірусу імунодефіциту і грибків (Candida albicans).Одним з механізмів такого антимікробної і антивірусної дії є взаємодія гістатіна-5 з різними протеиназами, виділеними з мікроорганізмів ротової порожнини. Також показано, вони зв'язуються з специфічними рецепторами грибів і формують канали в їх мембрані, що забезпечує транспорт в клітину іонів K +, Mg 2+ з мобілізацією АТФ з клітини. Мішенню для гістатінов в мікробних клітинах також є мітохондрії.
α- і ^ -Дефензіни -низькомолекулярні пептиди з мовляв. масою 3-5 кДа, що мають (3-структуру і багаті цистеїном. Джерелом α-дефензіни є лейкоцити, а (3-дефензіни - кератиноцити і слинні залози. дефензіни діють на грампозитивні і грамнегативні бактерії, гриби (Candida albicans)і деякі віруси. Вони формують іонні канали в залежності від типу клітин, а також агрегує з пептидами мембран і таким чином забезпечують перенесення іонів через мембрану. Також в бактеріальних клітинах дефензіни пригнічують синтез білків.
У антимікробної захисту також бере участь білок кальпротектін -пептид, що володіє потужним протимікробну дію і потрапляє в слину з епітеліоцитів і нейтрофілів.
Статеріни(Білки, багаті тирозином). З секрету привушних слинних залоз виділені Фосфопротеіни, що містять до 15% проліну і 25% кислих амінокислот, мовляв. маса якого дорівнює 5,38 кДа. Вони разом з іншими секреторними білками пригнічує спонтанну преципитацию фосфорнокальціевих солей на поверхні зуба, в ротовій порожнині і в слинних залозах. Статеріни пов'язують Ca 2+, пригнічуючи його осадження і освіту гідроксиапатиту в слині. Також ці білки мають здатність не тільки гальмувати зростання кристалів, але і фазу нуклеации (освіта затравки майбутнього кристала). Визначаються в емалевої пелликуле і зв'язуються N- кінцевий областю з гідроксиапатиту емалі. Статеріни спільно з гістатінамі інгібують зростання аеробних і анаеробних бактерій.
лактоферин- глікопротеїн, що міститься в багатьох секрети. Особливо його багато в молозиві і слині. Він пов'язує залізо (Fe 3+) бактерій і порушує окислювально-відновні процеси в бактеріальних клітинах, надаючи тим самим бактеріостатичну дію.
імуноглобуліни . Імуноглобуліни поділяють на класи в залежності від структури, властивостей і антигенних особливостей їх важких поліпептидних ланцюгів. У слині присутні всі 5 класів імуноглобулінів - IgA, IgAs, IgG, IgM, IgE. Основним імуноглобуліном порожнини рота (90%) є секреторний імуноглобулін А (SIgA, IgA 2), який виділяється привушні слинні залози. Решта 10% IgA 2 секретируются малими і піднижньощелепної слинних залоз. Цілісна слина у дорослих містить від 30 до 160 мкг / мл SIgA. Дефіцит IgA 2 зустрічається в одному випадку на 500 осіб і супроводжується частими вірусними інфекціями. Всі інші види імуноглобулінів (IgE, IgG, IgM) визначаються в меншій кількості. Вони надходять з плазми крові шляхом простої транссудации через малі слинні залози і зубодесневую борозенку.
лептин- білок з мовляв. масою 16 кДа бере участь в процесах регенерації слизової оболонки. Зв'язуючись з рецепторами кератиноцитів, викликає експресію факторів росту кератиноцитів і епітелію. Через фосфорилирование сигнальних білків STAT-1 і STAT-3 ці фактори росту сприяють диференціювання кератиноцитів.
глікопротеїн 340(gp340, ДП 340) - білок, багатий цистеїном, з мовляв. масою 340 кДа; відноситься до антивірусних білків. Будучи агглютинином ДП 340 в присутності Ca 2+ зв'язується з аденовірусами і вірусами, що викликають гепатит, ВІЛ-інфекцію. Він також взаємодії
діє з бактеріями ротової порожнини (Str. Mutans, Helicobacter pylori іін.) і пригнічує їх зчеплення при утворенні колоній. Пригнічує активність еластази лейкоцитів і таким чином захищає білки слини від протеолізу.
У слині також виявлені специфічні білки - салівопротеін, що сприяє відкладенню фосфорнокальціевих з'єднань на поверхні емалі зубів, і фосфопротеин - кальцій-зв'язуючий білок з високою спорідненістю до гидроксиапатиту, який бере участь в утворенні зубного каменю і зубного нальоту.
Крім секреторних білків в змішану слину з плазми крові надходять альбуміни і глобуліновие фракції.
ферменти слини. Провідну роль серед захисних факторів слини грають ферменти різного походження - а-амілаза, лізоцим, нуклеази, пероксидаза, карбоангидраза і ін. В меншій мірі це відноситься до амілази - основного ферменту змішаної слини, який бере участь в початкових етапах травлення.
Глікозідази.У слині визначається активність ендо- та екзоглікозі- даз. До ендоглікозідазам в першу чергу відноситься а-амілаза слини.
α-Амілаза.Слинна а-амілаза розщеплює а (1-4) -глікозидними зв'язку в крохмалі і глікогені. За своїм імунохімічний властивостям і амінокислотним складом слинна а-амілаза ідентична панкреатичної амілази. Певні відмінності між цими амілазами обумовлені тим, що слинна і панкреатична амілази кодуються різними генами (АМУ 1 і АМУ 2).
Ферменти а-амілази представлені 11 білками, які об'єднують в 2 сімейства: А і В. Білки сімейства А мають мовляв. масу 62 кДа і містять залишки вуглеводів, а ізоензими сімейства В ліше- ни вуглеводного компонента і мають меншу мовляв. масу - 56 кДа. У змішаній слині ідентифікований фермент, який відщеплює вуглеводний компонент і шляхом деглікозілірованія ізоамілази, і білки сімейства А перетворюються в протеїни сімейства В.
а-Амілаза виділяється з секретом паротідной залози і губних дрібних залоз, де концентрація її становить 648-803 мкг / мл і не пов'язана з віком, але змінюється протягом доби в залежності від чищення зубів і прийому їжі.
Крім а-амілази в змішаній слині визначається активність ще кількох гликозидаз - a-L-фукозідази, а- і (3-глюкозидаз, а- і (3-галактозидази, a-D-маннозідази, (3-глюкуронідази, (3-гіалу- ронідаза, β-N-ацетілгексозамінідази, нейрамінідази. Всі вони
мають різне походження і різні властивості. α-L-Фукозідаза виділяється з секретом привушних слинних залоз і розщеплює α- (1 »2) гликозидні зв'язку в коротких олігосахаридних ланцюгах. Джерелом β-N-D-ацетілгексозамінідази в змішаній слині є секрети великих слинних залоз, а також мікрофлори порожнини рота.
α- і (3-глюкозидази, α- і (3-галактозидази, (3-глюкуронідаза, нейрамінідаза і гіалуронідаза мають бактеріальне походження і найбільш активні в кислому середовищі. β-D-гіалуронідаза каталізує гідроліз β- (14) глікозидних зв'язків в гіалуронової кислоти та інших глікозаміногліканів. Зміна гіалуронідазну активності в слині корелює з числом грамнегативнихбактерій і зростає при запаленні ясен. Разом з гіалуронідазну активністю зростає активність (3-глюкуронідази, яка в нормі пригнічується інгібітором (3-глюкокуронідази, що надходить з плазми и крові.
Показано, що незважаючи на велику активність кислих гликозидаз в слині, ці ферменти здатні розщеплювати гликозидні ланцюга в слинних муцини з утворенням сіалових кислот і аминосахаров.
лізоцим -білок з мовляв. масою близько 14 кДа, поліпептидний ланцюг якого складається з 129 амінокислотних залишків і згорнута в компактну глобулу. Тривимірна конформація поліпептидного ланцюга підтримують 4 дисульфідні зв'язки. Глобула лізоциму складається з двох частин: в одній містяться амінокислоти, які мають гідрофобні групи (лейцин, ізолейцин, триптофан), в іншій частині переважають амінокислоти з полярними групами (лізин, аргінін, аспарагінова кислота).
Джерелом лізоциму в ротовій рідині є слинні залози. Лізоцим синтезується епітеліальними клітинами прото ков слинних залоз. Зі змішаною слиною в ротову порожнину надходить приблизно 5,2 мкг лізоциму в 1 хвилину. Іншим джерелом лізоциму є нейтрофіли. Бактерицидну дію лізоциму засноване на тому, що він каталізує гідроліз α (1-4) -глікозидними зв'язку, що з'єднує N-ацетилглюкозамин з N-ацетилмурамовой кислотою в полисахаридах клітинної оболонки мікроорганізмів, що сприяє руйнуванню муреина в стінці бактеріальної клітини (рис. 6.14).
При розміщенні гексасахарідного фрагмента муреина в активному центрі макромолекули лізоциму все моносахаридними ланки зберігають конформацию крісла, крім кільця 4, яке потрапляє в сліш-
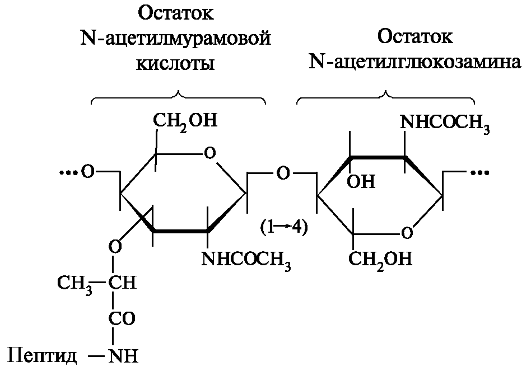
Мал. 6.14.Структурна формула муреина, присутнього в мембрані грампозитивних бактерій.
кому тісне оточення бічними радикалами залишків амінокислот. Кільце 4 відвідують понад напружену конформацию напівкрісла і при цьому ущільнюється. Глікозидна зв'язок між кільцями 4 і 5 распо- покладається в безпосередній близькості з амінокислотними залишками активного центру асп-52 і глу-35, які і беруть активну участь в її гідролізі (рис. 6.15).
Через гідролітичні розщеплення гликозидной зв'язку в полисахаридной ланцюга муреина руйнується бактеріальна клітинна стінка, що становить хімічну основу антибактеріальної дії лізоциму.
Найбільш чутливі до лізоциму грампозитивнімікроорганізми і деякі віруси. Освіта лізоциму знижується при деяких видах захворювань порожнини рота (стоматити, гінгівіти, пародонтити).
Карбоангидраза- фермент, що відноситься до класу ЛіАЗ. каталізує розщеплення зв'язку С-О у вугільній кислоті, що призводить до утворення молекул СО 2 і Н 2 О.
В ацинарних клітинах привушних і піднижньощелепних слинних залоз синтезується карбоангидраза VI типу і в складі секреторних гранул секретується в слину. Це білок з мовляв. масою 42 кДа і становить близько 3% від загальної кількості всіх білків в паротідной слині.
Секреція карбоангідрази VI в слину підпорядковується циркадних ритмів: її концентрація дуже низька під час сну і росте в денний час після пробудження і сніданку. Ця добова залежність дуже схожа
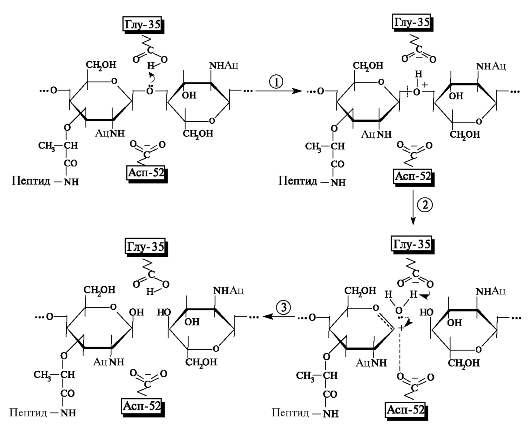
Мал. 6.15.гідроліз (3 (1-> 4) гликозидной зв'язку в муреин ферментом лізоцимом.
з β-амілазою слини і доводить позитивну кореляцію між рівнем активності слинної амілази і концентрацією карбоангідрази VI. Це доводить, що ці два ферменти секретуються по схожим механізмам і, можливо, є в одних і тих же секреторних гранулах. Карбангідраза регулює буферну ємність слини. Новітні дослідження показали, що карбоангидраза VI зв'язується з пеллікулой емалі і зберігає свою ферментативну активність на поверхні зуба. На пелликуле карбоангидраза VI бере участь у перетворенні гідрокарбонату і продуктів метаболізму бактерій в СО 2 і Н 2 О. Ускоряя видалення кислот з поверхні зуба, карбоангидраза VI захищає емаль зубів від демінералізації. Низьку концентрацію карбоангідрази VI в слині виявляють у людей з активним каріозною процесом.
пероксидазивідносяться до класу оксидоредуктаз і каталізують окіс- ня донора H 2 O 2. Остання в порожнині рота утворюється мікроорганіз-
мами і її кількість залежить від метаболізму сахарози і аминосахаров. Каталізує утворення H 2 O 2 фермент супероксиддисмутаза (рис. 6.16).
Мал. 6.16.Реакція дісмутірованія супероксид-аніону ферментом супероксиддисмутазой.
Слинні залози секретують в порожнину рота іони тіоціанатів (SCN -), Cl -, I -, Br -. У змішаній слині в нормі присутні слинна пероксидаза (лактопероксидаза) і мієлопероксидаза, а при патологічних станах з'являється глутатионпероксидаза.
Слинна пероксидаза відноситься до гемопротеинов і утворюється в ацинарних клітинах привушних і піднижньощелепних слинних залоз. Вона представлена множинними формами з мовляв. масою 78, 80 і 28 кДа. В секреті привушної залози активність ферменту в 3 рази вище, ніж в піднижньощелепної. Слинна пероксидаза окисляє тіоціанати SCN -. Механізм окислення SCN - включає декілька реакцій (рис. 6.17). Найбільше окислення SCN - слинної пероксидазой протікає при рН 5,0-6,0, тому антибактеріальний ефект цього ферменту збільшується при кислих значеннях рН. Утворений гіпотіоціанат (- ОSCN) при рН<7,0 подавляет рост Str. mutansі надає в 10 разів більше потужну антибактеріальну дейс-
твие, ніж Н 2 О 2. Разом з тим при зниженні рН зростає небезпека демінералізації твердих тканин зубів.
В процесі очищення і виділення слинної пероксидази було виявлено, що фермент знаходиться в комплексі з одним з ББП, що, мабуть, дозволяє брати участь цього ферменту в захисті емалі зуба від пошкодження.
З поліморфноядерних лейкоцитів звільняється мієлопероксидаза, окислююча іони Cl -, I -, Br -. Результатом взаємодії системи «пероксідазаперекісь водню-хлор» є утворення гіпохлориту
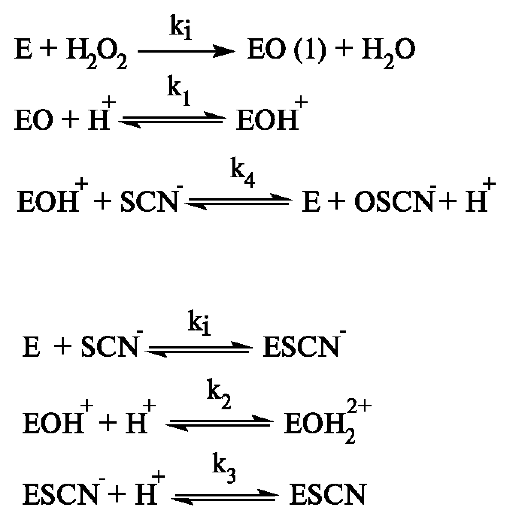
Мал. 6.17.Етапи окислення тіоціанатів слинної пероксидазою.
(HOCl -). Об'єктом дії останнього є амінокислоти білків мікроорганізмів, які перетворюються в активні альдегіди або інші токсичні продукти. У зв'язку з цим здатність слинних залоз, поряд з пероксидазою, екскретуватися в значних кіль- чествах іони SCN -, Cl -, I -, Br -. В також слід віднести до функції антимікробної захисту.
Таким чином, біологічна роль присутніх в слині пероксидаз полягає в тому, що, з одного боку, продукти окислення тіоціанатів, галогенів інгібують зростання і метаболізм лакто бацил і деяких інших мікроорганізмів, а з іншого боку, запобігає акумуляція молекул Н 2 О 2 багатьма видами стрептококів і клітинами слизової оболонки порожнини рота.
протеїнази(протеолітичні ферменти слини). У слині відсутні умови для активного розщеплення білків. Це обумовлено тим, що в ротовій порожнині немає денатуруючих факторів, а також присутня велика кількість інгібіторів протеїназ білкової природи. Низька активність протеїназ дозволяє зберігати білки слини в нативному стані і повноцінно виконувати свої функції.
У слині здорової людини визначається невисока активність кислих і слаболужних протеїназ. Джерелом протеолітичних ферментів в слині переважно є мікроорганізми і лейкоцити. У слині присутні тріпсіноподобних, аспартільние, серинові і матриксних металлопротеінази.
Тріпсіноподобних протеїнази розщеплюють пептидні зв'язки, в утворенні яких беруть участь карбоксильні групи лізину і аргініну. З слаболужних тріпсіноподобних протеїназ в змішаній слині найбільш активний калікреїн.
Кислий тріпсіноподобних катепсини В в нормі практично не визначається і його активність зростає при запаленні. Катепсин D - кисла протеиназа лізосомного походження відрізняється тим, що в організмі і в ротовій порожнині відсутня специфічний для неї інгібітор. Катепсин D звільняється з лейкоцитів, а також з запалених клітин, тому його активність збільшується при гінгівіті і пародонтиті. Матриксних металлопротеінази в слині з'являються при руйнуванні міжклітинного матриксу тканин пародонта, а їх джерелом є десневая рідина і клітини.
Білкові інгібітори протеїназ . Слинні залози є джерелом великої кількості секреторних інгібіторів протеїназ.
Вони представлені цістатіна і низькомолекулярними кіслотостабільний білками.
Кіслотостабільний білкові інгібітори витримують нагрівання до 90 ° С при кислих значеннях рН, не втрачаючи при цьому своєї активності. Це низькомолекулярні білки з мовляв. масою 6,5-10 кДа, здатні пригнічувати активність калікреїну, трипсину, еластази і катепсину G.
Цістатіна.У 1984 р дві групи японських дослідників незалежно один від одного повідомили про присутність в слині ще однієї групи секреторних білків - слинних цістатіна. Слинні цістатіна синтезуються в серозних клітинах привушних і піднижньощелепних слинних залоз. Це кислі білки з мовляв. масою 9,5-13 кДа. Всього виявлено 8 слинних цістатіна, з них 6 білків охарактеризовано (цістатіна S, подовжена форма цістатіна S-HSP-12, SA, SN, SAI, SAIII). Слинні цістатіна інгібують активність тріпсіноподобних протеїназ - катепсинов В, Н, L, G, в активному центрі яких присутній залишок амінокислоти цистеїну.
Цістатіна SA, SAIII беруть участь в утворенні придбаної пеллікули зубів. Цістатіна SA-III містить 4 залишки фосфосерин, які залучаються до зв'язування з гідроксиапатиту емалі зуба. Високий ступінь адгезії цих білків, ймовірно, пов'язана з тим, що цістатіна мають схожість в амінокислотноїпослідовності з іншими адгезивними білками - фібронектином і ламініном.
Вважають, що через пригнічення активності цистеїнових протеїназ слинні цістатіна виконують антимікробну і анти- вірусну функції. Вони також захищають білки слини від ферментативного розщеплення, оскільки секреторні білки можуть функціонувати тільки в интактном стані.
У змішану слину людини з плазми крові потрапляють α1 - інгібітор протеїназ (α 1 -антитрипсин), і α2 -макроглобуліну (α2-М). α 1 антитрипсину визначається тільки в однієї третини досліджуваних зразків слини. Це одноланцюговий білок, що складається з 294 амінокислотних залишків, який синтезується в печінці. Він конкурентно інгібує мікробні і лейкоцитарні серинові протеїнази, еластазу, коллагеназу, а також плазмин і калікреїн.
α2 -макроглобуліну - глікопротеїн з мовляв. масою 725 кДа, що складається з 4 субодиниць і здатний пригнічувати будь-які протеїнази (рис. 6.18). Синтезується в печінці і в слині визначається тільки у 10% обстежуваних здорових людей.
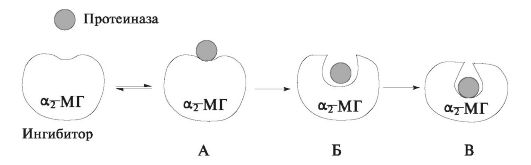
Мал. 6.18.Схема механізму інгібування протеїнази α 2 -макроглобуліну: А -активна протеиназа зв'язується з певною ділянкою молекули α 2 -макроглобуліну і утворюється неміцний комплекс α 2 -макроглобу- лин - протеиназа; Б -фермент розщеплює специфічну пептидний зв'язок ( «приманка»), що призводить до конформаційних змін молекули білка α 2 -макроглобуліну; В -протеиназа ковалентно зв'язується з ділянкою в молекулі α 2 -макроглобуліну, що супроводжується утворенням більш компактною структури. Утворився комплекс з струмом слини видаляється в шлунково-кишковий тракт.
У змішаній слині велика частина білкових інгібіторів протеїназ знаходиться в комплексі з протеолітичними ферментами, і тільки невелика кількість у вільному стані. При запаленні кількість вільних інгібіторів в слині зменшується, а що знаходяться в комплексах інгібітори піддаються часткового протеолізу і втрачають свою активність.
Секрет слинних залоз є джерелом інгібіторів протеїназ, то їх використовують для приготування лікарських пре- Параті ( «Трасилол», «Контрикал», «Гордокс» і ін.).
Нуклеази (РНК-ази і ДНК-ази) грають важливу роль в здійсненні захисної функції змішаної слини. Основним джерелом їх в слині є лейкоцити. У змішаній слині виявлено кислі і лужні РНК-ази і ДНК-ази, що відрізняються різними властивостями. В експериментах було показано, що ці ферменти різко уповільнюють зростання і розмноження багатьох мікроорганізмів в ротовій порожнині. При деяких запальних захворюваннях м'яких тканин порожнини рота їх кількість збільшується.
фосфатази- ферменти класу гідролаз, отщепляющие неоргані- ний фосфат від органічних сполук. У слині вони представлені кислої і лужної фосфатази.
кисла фосфатаза (PH 4,8) міститься в лізосомах і потрапляє в змішану слину з секретами великих слинних залоз, а
також з бактерій, лейкоцитів і епітеліальних клітин. У слині визначається до 4 ізоферментів кислої фосфатази. Активність ферменту в слині, як правило, збільшується при пародонтиті та гінгівіті. Є суперечливі відомості про зміну активності цього ферменту при карієсі зубів. лужна фосфатаза(РН 9,1-10,5). В секретах слинних залоз здорової людини активність лужної фосфатази низька і її походження в змішаній слині пов'язують з клітинними елементами. Активність цього ферменту, також як і кислої фосфатази, збільшується при запаленні м'яких тканин порожнини рота і карієсі. Разом з тим отримані дані про активність цього ферменту дуже суперечливі і не завжди вкладаються в певну схему.
6.5. САЛІВАДІАГНОСТІКА
Дослідження слини відноситься до неінвазівазівним методам і проводиться для оцінки вікового і фізіологічного статусу, виявлення соматичних захворювань, патології слинних залоз і тканин порожнини рота, генетичних маркерів, моніторингу лікарських засобів.
З появою нових кількісних методик для лабораторних
досліджень все частіше використовують змішану слину. перевагою
таких методів в порівнянні з дослідженням плазми крові є:
Неінвазивний збір слини, що робить зручним її отримання як
у дорослих, так і дітей; відсутність у пацієнта стресу при проведенні процедури отримання слини; можливість використовувати прості прилади й пристосування
для отримання слини; відпадає необхідність присутності лікаря та середнього медичного персоналу при заборі слини; існує можливість повторного і неодноразового отримання матеріалу для досліджень; слина може певний час зберігатися на холоді до проведення досліджень. Нестимульований змішану слину отримують при спльовуванні після полоскання ротової порожнини. Слину великих слинних залоз збирають шляхом катетеризації їх проток і збору в капсули Лешли-Красногорського, що фіксуються до слизової оболонки рота над
протоками привушних, піднижньощелепної і під'язикової слинних залоз. Під впливом стимуляторів слинної секреції (жування їжі, парафіну, нанесення кислих і солодких речовин на смакові цибулини мови) утворюється стимульована слина. У виділилася за певний час слині з урахуванням її обсягу визначають в'язкість, рН, вміст електролітів, ферментів, муцина та інших білків і пептидів.
Для оцінки функціонального стану слинних залоз обов'язково вимірюють кількість виділилася стимульованої і нестимульований слини за певний час; потім розраховують швидкість секреції в мл / хв. Зменшення кількості виділеної слини супроводжується зміною її складу і спостерігається при стресі, зневодненні, під час сну, наркозу, в літньому віці, при нирковій недостатності, цукровому діабеті, гіпотиреозі, психічні порушення, хвороби Шегрена, слюннокаменной хвороби. Значне зменшення кількості слини призводить до розвитку сухості в порожнині рота - ксеростомія. Підвищена секреція (гіперсалівація) спостерігається при вагітності, гіпертиреозі, запальних захворюваннях слизової оболонки порожнини рота.
Кількісний та якісний склад слини залежить від фізіологічного статусу та віку; наприклад, в слині немовлят до 6 міс міститься в 2 рази більше іонів Na + в порівнянні зі слиною дорослого, що пов'язано з процесами реабсорбції в слинних залозах. З віком в слині збільшується кількість IgА, тіоціанатів, швидко мігруючих форм ізоферментів амілази.
Слина є джерелом генетичних маркерів. За ліморфізм білків, наявність водорозчинних гликопротеинов, обла- дають антигенної специфічністю, відображає число локусів і алелей, а також частоту алелей у різних людських рас, що має велике значення в антропології, популяційної генетики, судової медицини.
Вимірювання концентрації гормонів в слині дозволяє оцінити стан надниркових залоз, гонадотропну функцію, ритми образо- вання і виділення гормонів. Слину досліджують для оцінки метаболізму лікарських речовин, наприклад, етанолу, фенобарбіталу, препаратів літію, саліцилатів, діазепаму та ін. Разом з тим кореляційний зв'язок між кількісним поруч ліків в крові і слині існує не завжди, що і ускладнює використання слини в моніторингу лікарських засобів.
Певні зрушення в складі як змішаної слини, так і з проток, виявляються при різних соматичних захворюваннях. Так, при уремії, що виникає при нирковій недостатності, і в слині і в сироватці крові збільшується кількість сечовини і креатиніну. При артеріальній гіпертензії в паротідной слині збільшується рівень цАМФ, загального кальцію, іонів K +, але знижується концентрація іонів Ca 2+. При поликистозе яєчка, що супроводжується безпліддям, в слині підвищується концентрація вільного тестостерону, а при ураженні наднирників і використанні в замісної терапії кортизолу в слині збільшується утримуючи ня 17 α-гідрокситестостерон. У пацієнтів з гіпофункції гіпофіза, бронзової хвороби визначення кортизолу в слині є більш інформативним, ніж в сечі і слині. Для стресу теж характерно підвищення кількості кортизолу. Концентрація кортизолу в слині має циркадний ритмічність і знаходиться в залежності від психоемоційного стану. На ранніх термінах вагітності і при раку печінки в слині з'являється хоріонічний гонадотропін. При пухлинах щитовидної залози в слині зростає концентрація тиреоглобуліну; при гострому панкреатиті збільшується кількість панкреатичної і слинної α-амілази і ліпази. У хворих з гіпофункцією щитовидної залози концентрація тироксину і трийодтироніну в слині знижується майже вдвічі, а тиреотропіну (ТТГ) підвищується в 2,8 рази в порівнянні з показниками у здорових осіб.
Зміни складу слини спостерігаються при ураженні слинних залоз. При хронічному паротиті зростає транссудация сироваткових білків, зокрема, альбуміну, збільшується секреція кал- лікреіна, лізоциму; їх кількість зростає в період загострення. При пухлинах залоз змінюється не тільки кількість секрету, а й в слині з'являються додаткові фракції білків, переважно сироваткового походження. Для синдрому Шегрена характерно зниження слюнообразованіе і слиновиділення, що пов'язано з пригніченням функцій транспортних білків аквапорінов. Транспорт води із ацинарних клітин знижується, що призводить до набухання клітин і їх пошкодження. У слині цих хворих збільшується кількість IgА і IgМ, активність кислих протеїназ і кислої фосфатази, лактоферину і лізоциму; змінюється вміст іонів Na +, Cl -, Ca 2+ і PO 4 3-.
Хоча в складі слини при карієсі не виявлено значних відхилень (і відомості ці вкрай суперечливі), все-таки поки-зано, що у карієсрезистентності осіб вміст амілази значно
вище, ніж у вразливість. Є також дані, що при карієсі збільшується активність кислої фосфатази, зменшується кількість (3-дефензіни, змінюється активність лактатдегідрогена- зи, знижується рН слини і швидкість слиновиділення.
Запалення пародонта супроводжується підвищенням в слині активності катепсинов D і В і слаболужних протеїназ. При цьому падає вільна антітріптіческая активність, але в 1,5 рази зростає активність місцево вироблюваних кіслотостабільний інгібіторів протеїназ, велика частина яких знаходиться в комплексі з протеиназами. Змінюються і властивості самих кіслотостабільний інгібіторів, що пов'язано з освітою їх частково розщеплених форм під дією різних протеїназ. У слині зростає активність АЛТ і АСТ. Для пародонтиту характерно підвищення активності гіалуронідази, (3-глюкуронідази та її інгібітору. Активність пероксидази зростає в 1,5-1,6 рази, а вміст лізоциму знижується на 20-40%. Зміни захисної системи поєднуються зі збільшенням кількості тіоціанатів в 2-3 рази. Вміст імуноглобулінів коливається неоднозначно, але завжди збільшується кількість плазмових IgG і IgМ.
При запаленні пародонта і патології слизової оболонки порожнини рота активується вільнорадикальне окислення, яке характеризується збільшенням кількості в слині малонового діальдегіду і підвищенням активності супероксиддисмутази. З плазми крові при кровоточивості ясен, а також через десневую рідина в слину надходить глутатионпероксидаза, активність якої в нормі не визначається.
При пародонтиті також змінюється активність нітратредуктази і вміст нітритів. При легкої і середньої тяжкості пародонтиту активність нітратредуктази знижується, однак при загостренні процесу при пародонтиті важкого ступеня активність ферменту зростає в порівнянні з нормою вдвічі, а кількість нітритів зменшується в 4 рази.
Григор'єв І.В., Уланова Е.А., Артамонов І.Д. Білковий склад змішаної слини людини: механізми психофізіологічної регуляції // вісник РАМН. 2004. № 7. С. 36-47.
1 Григор'єв І.В., 2 Артамонов І.Д., 3 Уланова Е.А.
1 Російський науковий центр відновлювальної медицини і курортології МОЗ РФ,
2 Інститут біоорганічної хімії ім.М.М.Шемякіна і Ю.А.Овчіннікова РАН,
3 Вітебський державний медичний університет
У минулі десять років спостерігався сильний сплеск уваги до вивчення слини і її властивостей. Численні дані, отримані в цій області науки, дозволяють зробити висновок, що слина людини являє собою унікальну субстанцію, що має великі потенційні можливості для використання в фундаментальних дослідженнях і в медичній діагностиці. Найбільшу увагу в даний час приділяється вивченню перспектив аналізу слини в діагностичних цілях. Це обумовлено цілим рядом причин. Так, використання слини може бути не тільки додатковим методом в клінічних дослідженнях, а й має багато переваг у порівнянні з аналізом крові і сечі: збір слини простий і зручний для випадків неклінічних навколишніх умов; він безболісний; ризик зараження медперсоналу значно менше, ніж при роботі з кров'ю; зміст деяких молекул (наприклад, певних гормонів, антитіл і ліків) в слині відображає їх концентрацію в крові. Також слина може бути джерелом для вивчення ДНК людини і знаходяться в організмі мікробів. Висловлюється думка, що розширення використання слини в клінічному аналізі допоможе прискорити перехід від діагностики захворювань до спостереження за здоров'ям. Високі потенційні можливості для використання слини з метою виявлення системних захворювань і локальних патологій. Наявність певних кореляцій між розладами різних фізіологічних систем і функціональною активністю слинних залоз дало привід деяким дослідникам називати ці залози «дзеркалом хвороб». Ми, в свою чергу, вважаємо, що є всі підстави розглядати слину (особливо змішану слину, яка є результатом активності всіх слинних залоз) як «дзеркало» психофізіологічного стану організму.
Незважаючи на великий обсяг анатомо-фізіологічних даних про слинних залозах і їх секреторних виділеннях, залишається невирішеним до кінця питання про те, як саме працює механізм, який керує формуванням біохімічного складу слини. В даний час значна частина дослідників схиляється до висновку про вирішальну роль психоемоційних факторів в цих процесах.
Одним з найбільш плідних напрямків є дослідження кореляцій психоемоційного стану та вмісту білків в слині. У своїх експериментах ми виявили, що психоемоційний стан людини контролює білковий склад змішаної слини. У цій статті ми представляємо: 1) короткий узагальнення сучасних даних про білках слини; 2) основні результати наших досліджень щодо впливу психоемоційного стану на білковий склад слини; 3) опис ключових елементів передбачуваного психофізіологічного механізму, який управляє формуванням білкового складу слини людини.
Як відомо, формування слини відбувається за допомогою трьох пар великих слинних залоз (привушних / gl. Parotis, підщелепних / gl. Submaxillares, під'язикові / gl. Sublingules) і великої кількості (600-1000) малих слинних залозок, локалізованих на слизовій оболонці губ, мови, ясен, піднебіння, щік, мигдалин і носоглотки. Кожна з цих залоз утворює свій власний слинної секрет, який виділяється в ротову порожнину і бере участь у формуванні «кінцевої» субстанції - змішаної слини.
Змішана слина виконує різноманітні функції: травну, Мінераліз, що очищає, захисну, бактерицидну, імунну, гормональну і ін .; в зв'язку з чим вона має складний біохімічний склад, у формуванні якого беруть участь різноманітні білки, ліпіди (холестерин і його ефіри, вільні жирні кислоти, гліцерофосфоліпіди і т.д.), стероїдні сполуки (кортизол, естроген, прогестерон, тестостерон, дегідроепіандростерон, андростерон , 11-ОН-андростенедион і ін.), вуглеводи (олігосахаридні компоненти муцинов, вільні глікозаміноглікани, ді-і моносахариди), іони (Na +, K +, Ca 2+, Li +, Mg 2+, I -, Cl - , F - і т.д.), небілкові азотовмісні речовини (сечовина, сечова кислота, креатин, аміак, вільні амінокислоти), вітаміни (С, В1, В2, В6, Н, РР і т.д.), циклічні нуклеотиди та інші сполуки. У слині виявлено також у відносно невеликій кількості лейкоцити, бактерії та частини слущивающихся клітин епітеліальної тканини. Щодня у людини виділяється 0,5-2 літра слини. Понад 90% всієї маси слинного секрету доводиться на воду.
Найважливішим компонентом слини є білкові сполуки, значну частину яких умовно можна розділити за своїми функціональними властивостями на три групи: що беруть участь в травних процесах, пов'язані з місцевим імунітетом і виконують регуляторні функції.
Білки, які беруть участь в травних реакціях, Представлені гидролитическими ферментами, основним з яких є α- амілаза (Розщеплює α-1-4-глюкозидні зв'язку гомополісахаридів до мальтози і невеликих олигосахаридов), яка може становити до 10% всіх білків слини. Крім амілази до складу слини входять такі травні ферменти як: мальтаза, гіалуронідаза, тріпсіноподобних ферменти, пепсиноген, пептідази, естерази, ліпази, нуклеази, пероксидази, кислі і лужні фосфатази, лактопероксидазаі т.д. Показано, що частина цих ферментів секретується слинними залозами (напр., Амілаза і лактопероксидаза), ряд інших надходить з крові (напр., Пепсиноген) або мають «змішане» походження (напр., Кисла і лужна фосфатази) і деякі є продуктами метаболізму лейкоцитів або мікробів (напр., мальтаза, альдолаза).
Імунні фактори слини представлені в основному імуноглобуліном А і в меншій мірі IgG, IgM і IgE . Неспецифічними захисними властивостями володіють такі білки слини. лізоцим, Низькомолекулярний білок, гідролізує β-1-4-глікозидний зв'язок полісахаридів і мукополісахаридів, що містять мурамовую кислоту, в клітинних стінках мікроорганізмів. лактоферинбере участь в різних реакціях захисту організму і регуляції імунітету. Малі Фосфопротеіни, гістатіни і статеріни, Грають важливу роль в антимікробному дії. цістатіна є інгібіторами цистеїнових протеїназ і можуть виконувати захисну роль при процесах запалення в ротовій порожнині. муцини - великі глікопротеїни, які в основному забезпечують в'язку природу слини - запускають специфічну взаємодію між стінкою бактеріальних клітин і комплементарними галактозіднимі рецепторами на мембрані епітеліальних клітин. Подібні властивості виявлені також у амілази, фибронектина і β 2 мікроглобуліну .
Третю велику групу білків слини складають біологічно активні речовини, Регулюючі функції різноманітних систем організму. Так слинні залози виділяють цілий ряд речовин з гіпо- та гіпертензивним дією: калликреин, гістамін, ренін, тонин та ін. Білкові фактори слини людини, що впливають на гемопоез, представлені еритропоетином, фактором гранулоцітоз, тімоціттрансформірующім і колонієстимулюючим факторами. Широко представлені в слині різноманітні ростові регулятори: фактори росту нервів, епідермісу, мезодерми, фібробластів; інсулін-подібний фактор росту та ін. Більшість біологічно активних факторів слини є пептидами або гликопротеинами. Для багатьох з них (фактори росту нервів і епідермісу, паротин, калікреїн, тонин і ін.) Доведено, що вони виділяються з слинних залоз як у ротову порожнину, так і в кровоносне русло.
низькомолекулярні білкислини з молекулярної масою< 3 кДа образуются в основном путём протеолиза пролин-обогащённых белков, гистатинов и статеринов .
У слині людини також виявлені різні нейропептиди: метіонін-енкефалінів, субстанція Р, β -ендорфін , нейрокинин А, нейропептидY, вазоактивний шлунковий поліпептид, кальцитонін-генерований пептид .
Одним з найважливіших методів аналізу білкового складу слини є електрофорез. Використання для цієї мети електрофорезу в 12% -му поліакриламідному гелі дало різні результати у різних дослідницьких груп. Shiba A. et al. отримав 22 білкові смуги в препаратах з змішаної слини, Oberg S.G. et al. - 29 смуг, Rahim Z.H. et al. - 20 смуг. Сучасна приладова база дозволяє виявити до 30-40 різних білкових фракцій в одновимірних електрофореграмах слинних препаратів. При цьому індивідуальні відмінності білкових електрофореграм слини виявляються, як правило, в концентрації окремих білків, а не в їх кількості. Повторний збір слини одних і тих же людей показав зберігається сталість білкового спектра у них.
Незважаючи на велику кількість наукових даних про слинних залозах і слині, до сих пір не ясно, як саме працює фізіологічний механізм, який регулює білковий склад слини.
Як відомо, слинні залози мають багату іннервацію волокнами вегетативної нервової системи. Тому природно припускати, що нервова система є основним регулятором функцій слинних залоз і, в кінцевому підсумку, білкового складу слини. Дані про участь нервової системи і психоемоційних факторів в цій регуляції будуть обговорені нижче.
Чи не відносяться безпосередньо до активності нервової системи різні фізіологічні і фізичні фактори, як ми припускаємо, є другорядними по відношенню до формування білкового складу слини. Як показує велику кількість досліджень, фізичні і фізіологічні чинники або не мають яскраво вираженого впливу на весь білковий склад слини або ж змінюють зміст в слині одного або декількох білків. Так наприклад, вік , підлога , Циркадні ритми , харчові ефекти не мають значних впливів на білковий склад слини. З іншого боку виявлені зміни рівня певних білків на тлі: захворювань (Карієсу - IgA, пародонтозу - інгібітор металопротеаз-1, псоріазу - лізоцим, запалення порожнини рота - фактор росту епідермісу), куріння - фактор росту епідермісу, фізичного навантаження - IgA. Разом з тим, наприклад, при карієсі середньостатистичний рівень великих фракцій білків в слині не змінюється.
До числа інших факторів, які могли б впливати на концентрацію певних білків слини, також відносять: місячні цикли і вагітність , медикаментозне лікування , білковий поліморфізм , популяційні особливості людини, спадковість, специфічні відмінності в білок-микробном взаємодії, сінергічное або антагонічное взаємодія між білками.
Однак, вплив вищеописаних різноманітних факторів на білковий склад слини поки недостатньо досліджено.
Другим після нервової системи універсальним фізіологічним елементом, які беруть участь в регуляції формування білкового складу слини, вважається гемато-саліварний бар'єр .
Передбачається, що на синтез різних білків в слинних залозах надають регуляторний вплив гормональні речовини, такі як пролактин, андрогени, тироїдні гормони і кортикостероїди, що впливають на секреторні клітини через гемато-саліварний бар'єр. Однак, в цілому питання про роботу гемато-саліварного бар'єру поки мало вивчений.
Факт впливу психоемоційного стану на величину слинного потоку був неодноразово підтверджений як на початку ХХ століття, так і в його кінці. Однак, питання про вплив психіки на біохімічний (і зокрема, білковий) склад слини залишався досі відкритим. В силу різних причин не вдавалося сформувати ясну і адекватну теорію в цій області психофізіології. Частково така ситуація була пов'язана з методичними труднощами (складність обліку одночасного впливу різноманітних фізіологічних чинників, а також об'єктивної оцінки одномоментного психоемоційного стану людини і т.п.). Тому, як правило, для оптимізації вивчення впливу різних психоемоційних станів на фізіологію слюноотделітельних процесів використовують різні стандартні психічні і психофізичні навантаження (розумові тести, ігрові ситуації та інші психофізичні навантаження).
В ході цих досліджень було виявлено, що певні види психоемоційного стресу викликають зміну в слині рівня інгібіторів моноаміноксидази А і В, калікреїну, катехоламінів, кортизолу, інтенсивності вільно радикальних процесів і активності антиоксидантних ферментів. Також було показано, що зміст секреторного імуноглобуліну А знижувалося при емоційному переживанні і хронічному стресі, але підвищувався при емоційному роздратування, гострому стресі і позитивному настрої. У зв'язку з такою реакцією рівня IgA висловлювалися припущення про вплив настрою на імунітет, але серйозних робіт в цьому напрямку і розвитку цієї очевидної ідеї поки не проведено.
Крім вищезгаданого, було виявлено, що концентрація кортизолу в слині дітей корелює з їх поведінковими реакціями. Рівень тестостерону в слині дітей узгоджується з їх здатністю до навчання, а також з деякими депресивними станами у дорослих. На те, що ідея використання стероїдних гормонів для оцінки станів психіки залишається досить привабливою для дослідників, вказує наявність декількох десятків публікацій за останнє десятиліття, більшість з яких присвячено впливу настрою на вміст кортизолу і тестостерону в слині.
До сих пір в більшості випадків дослідники намагалися оцінити вплив психоемоційного стану на рівень певної речовини в слинних секреті. Ми виявили в своїх дослідженнях, що спостереження одночасно рівня багатьох білків за допомогою електрофорезу в поліакриламідному гелі дуже інформативно для виявлення кореляції між психоемоційним станом і білковим складом слини.
Слина у обстежуваних осіб збиралася (шляхом звичайного сплёвиванія в чистий хімічний стакан) вранці до їжі в кількості до 200 мкл. Після чого вона Центрифуговані 10 хв при 10000 об / хв і зберігалася в морозильній камері при -20 ° С.
Для денатурації білків слини в кожну отриману пробу додавали 1/2 (від її обсягу) буфера, що містить 100 мМ Тріс (рН 7,5), 7% додецилсульфату натрію, 2% меркаптоетанол, 0,02% бромфенолового блакитного, 20% гліцерину. Суміш ретельно струшували і інкубували 10 хв при 20 ° С. 20 мкл з кожного отриманого таким чином препарату слини використовували для електрофоретичного аналізу в поліакриламідному гелі за методом Laemmli U. K.. Електрофорез здійснювався в 12% поліакриламідному гелі товщиною 0,75 мм і розмірами 10х8 см.
Для визначення локалізації білків, гель після електрофорезу інкубували 1 годину в що обробляється розчині (25% етиловий спирт, 10% оцтова кислота, 2 мг / мл кумасі синій), потім двічі промивали дистильованою водою і інкубували 1-2 години в обескрашівающем розчині (25 % етиловий спирт, 10% оцтова кислота) до виразного прояву смуг білкових фракцій.
Слина для аналізу збиралася у людей, що мали різні психоемоційні стану: контрольна група - люди без розладів психіки (n = 85); групи стаціонарних пацієнтів з депресивним синдромом різної глибини і виду (на тлі психічних / n = 90 / і соматичних / n = 80 / захворювань), тривожним розладом (n = 4), на шизофренію (n = 36), наркозалежністю (n = 30) , панічним синдромом (n = 4), розладом особистості (n = 10). Досліджувалися також впливу позитивних і негативних природних і штучно-викликаних (міркування про приємне і неприємне) психоемоційних станів.
Зіставлення електрофоретичних картин білкового складу змішаної слини і психоемоційного стану, на тлі якого були взяті проби, дозволило нам виявити, що між ними існує виразне відповідність. Виявилося, що білковий склад змішаної слини чуйно реагує на зміну психоемоційного стану, при цьому відбувається специфічна трансформація білкового складу.
Вивчені нами електрофоретичні картини білкового складу змішаної слини (в цілому більше 1200 шт.) Можуть бути умовно розподілені на вісім основних груп, які різняться між собою певним співвідношенням переважаючих білкових фракцій. Ми припускаємо, що таке число спостережуваних типів білкового складу змішаної слини визначається кількістю можливих поєднань спільної активності трьох вегетативних нервових центрів, що регулюють роботу великих слинних залоз.
На рис. 1 представлена одна з можливих найпростіших схем зв'язку сукупної активності цих трьох нервових центрів з картиною білкового складу слини, що спостерігається за допомогою електрофорезу в поліакриламідному гелі. Ми умовно припустили, що активність кожного з даних центрів окремо контролює в слині рівень білків з певною молекулярною масою:
при активності тільки симпатичного шийного центру (Ш), в ротову порожнину виділяються переважно білки з молекулярною масою в області 50-60 кДа;
при активності тільки верхнього слюноотделительного ядра (В), в ротову порожнину виділяються переважно білки з молекулярною масою в області 30-35 кДа;
при активності тільки нижнього слюноотделительного ядра (Н), в ротову порожнину виділяються переважно білки з молекулярною масою в області< 30 кДа.
З цих припущень випливає, що:
спільна активність верхнього слюноотделительного ядра і шийного центру при неактивному нижньому слюноотделительную ядрі (ВШ) повинна супроводжуватися переважанням в змішаній слині білків в областях 30-35 кДа і 50-60 кДа;
спільна активність нижнього і верхнього слюноотделітельних ядер при неактивному шийному центрі (НВ) повинна супроводжуватися переважанням в змішаній слині білків з молекулярною масою ≤ 30 кДа;
спільна активність нижнього слюноотделительного ядра і шийного центру при неактивному верхньому слюноотделительную ядрі (НШ) повинна супроводжуватися переважанням в змішаній слині білків з молекулярною масою 50-60 кДа і< 30 кДа;
спільна активність всіх трьох вегетативних нервових центрів (НВШ), що регулюють слинні залози, буде супроводжуватися високою концентрацією в змішаній слині білків з молекулярною масою 50-60 кДа, 30-35 кДа і< 30 кДа;
відсутність активності в нижньому і верхньому слюноотделітельних ядрах і в шийному центрі (НВШ) буде супроводжуватися сильним зменшенням рівня білків по всьому спостережуваному діапазону молекулярних мас.
Усередині кожної з восьми описаних груп білкового складу змішаної слини існує певний різноманітність додаткових деталей.
Перераховані варіанти сукупної активності трьох вегетативних нервових центрів, що регулюють великі слинні залози, є, як ми думаємо, основний елемент контролю білкового складу змішаної слини.
Ми припускаємо, що двома іншими важливими факторами управління білкового складу змішаної слини є гемато-саліварний бар'єр і малі слинні залози. Хоча ці чинники грають, швидше за все, модулирующую роль, вносячи додаткові деталі в картину білкового складу змішаної слини, що формується секреторною активністю великих слинних залоз під дією трьох згаданих вегетативних центрів.
Гемато-саліварний бар'єр, як передбачається, також регулюється вегетативною нервовою системою, під контролем якої він, ймовірно, може змінювати свою проникність для певних білків, посилюючи їх транспорт з крові в слину. Ця область поки слабо вивчена.
Секреції малих слинних залоз багаті білком, але питання про регуляцію цих залоз і про внесок їх секреций в змішану слину також мало досліджені.
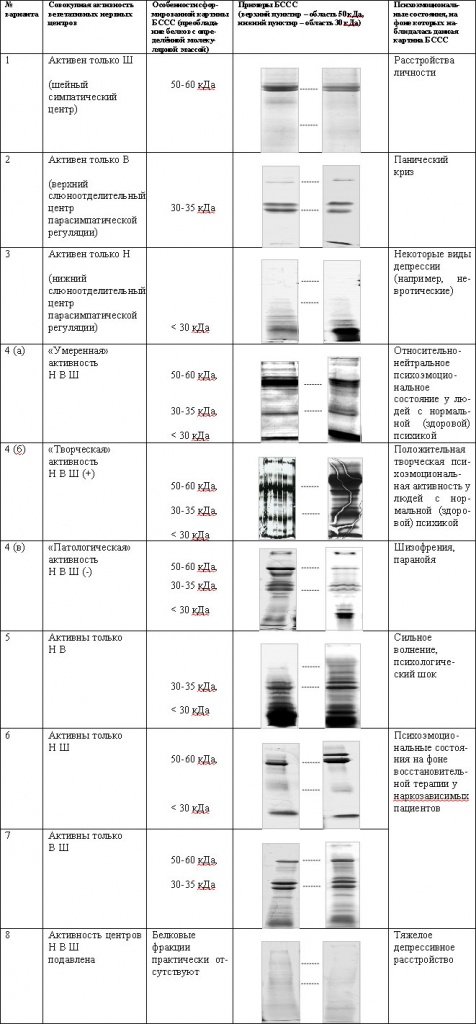 |
|
| Таблиця 1. Передбачувані основні типи картин білкового складу змішаної слини, відповідні восьми можливих варіантів сукупної активності трьох вегетативних нервових центрів (Ш - симпатичний в шийному відділі хребта, В і Н - відповідно верхній і нижній слюноотделительную парасимпатические центри в головному мозку), що регулюють великі слинні залози. |
Як було згадано вище, в своїх дослідженнях ми виявили, що картина білкового складу змішаної слини залежить від характеру психоемоційного стану людини. У таблиці 1 представлена інформація про те, на тлі яких психоемоційних станів спостерігаються ті чи інші картини білкового складу змішаної слини.
Найбільш часто спостерігається картиною білкового складу змішаної слини є варіант НВШ (табл. 1, 4а). Він характерний для відносно-нейтрального (спокійного) психоемоційного стану людини зі звичайною здоровою психікою. Цей варіант умовно позначений як «помірна» активність центрів НВШ. При спостереженні окремих людей протягом різних проміжків часу (дні, тижні, місяці) ми виявили, що картина білкового складу змішаної слини практично не змінює свого виду, якщо слина береться у відносно нейтральному (спокійному, природному) для даної людини психоемоційному стані. Зміни білкового складу змішаної слини в таких випадках, як правило, дуже незначні і пов'язані переважно з коливаннями рівня однієї-двох, рідко більше, білкових фракцій. Ці результати підтверджуються зокрема дослідженнями Oberg et al. .
При посиленою позитивної творчої психоемоційної активності, білковий склад змішаної слини значно збагачується білком, особливо в області 50-60 кДа (табл. 1, 4б). Ми припускаємо, що в цих станах посилюється діяльність симпатичної гілки нервової системи. Цей варіант умовно позначений нами як «творча» активність центрів НВШ. Аналогічні картини білкового складу змішаної слини ми спостерігали також у випадках позитивних природних емоцій, характерних для так званого «піднесеного» або радісного настрою.
З іншого боку, при захворюваннях шизофренічного характеру може також відбуватися збільшення білків по всьому спостережуваному діапазону молекулярних мас і зокрема в областях 50-60 кДа і 30-35 кДа (табл. 1, 4в). Однак в даних випадках в цих областях спостерігається специфічна деформація електрофоретичних треків у вигляді еліпсоідних форм і дугоподібних згинань білкових смуг. Ми припускаємо, що це може бути пов'язано або з якоїсь специфічної модифікацією білків з слинних залоз, або ж з присутністю в слині проникли з крові певних білкових речовин. Цей варіант нами позначений умовно як «патологічна» активність центрів НВШ.
Всі інші представлені варіанти картин білкового складу змішаної слини (табл. 1, варіанти 1-3, 5-8) спостерігалися при певних природних психоемоційних навантаженнях, пов'язаних переважно з психопатологічними станами. Серед цих спостережень одним з найбільш цікавих є те, що різні форми депресії викликають помітне зменшення рівня білків в змішаній слині (табл. 1, варіанти 3, 8). Останні дані представлені в нашій більш ранній публікації, де описана кореляція між рівнем білкової фракції поблизу 55 кДа і показаннями шкали депресії тесту ММPI. Для з'ясування деталей впливу різних інших психопатологічних станів на білковий склад змішаної слини потрібні подальші ретельні дослідження.
При аналізі білкового складу змішаної слини на тлі різноманітних психоемоційних станів нами було виявлено, що білкова фракція поблизу області 55 кДа є найбільшою у переважної більшості досліджених людей. Разом з тим, рівень цієї фракції в різних випадках може змінюватися в дуже широкому діапазоні, цілком ймовірно, на один-два порядки.
За нашими спостереженнями, велика різноманітність картин білкового складу змішаної слини можна розділити, як уже говорилося, на обмежене число груп з певними ознаками. Межі між цими групами не є жорсткими, тому що існують проміжні види білкового складу змішаної слини з загальними ( «междугрупповимі») ознаками. Така різноманітність має свою «родзинку» - воно відображає індивідуальні психофізіологічні нюанси досліджуваного людини і являє природодослідникові вкрай цікаву і важливу можливість для вивчення психологічної сфери. На жаль, докладний розгляд різноманітності білкового складу змішаної слини на тлі широкого спектра психоемоційних станів виходить за рамки цієї статті, тому перейдемо до розгляду даних, що описують ключові елементи психофізіологічного механізму, який здійснює контроль білкового складу слини.
Як було згадано вище, основними елементами психофізіологічної регуляції білкового складу змішаної слини людини вважаються центри вегетативного контролю великих слинних залоз. Ці залози іннервуються симпатичними і парасимпатичними нервами (рис. 2). Парасимпатична регуляція підщелепних і під'язикові залоз здійснюється за рефлекторну дугу, що включає в себе: нейрони верхнього слюноотделительного ядра в стовбурі головного мозку; прегангліонарних волокна, що йдуть в складі барабанної струни до підщелепної і під'язиковим вузлів, які розташовані в тілі кожної з відповідних залоз. Від цих гангліїв відходять постгангліонарні волокна до клітин слинних залоз. Нижня слюноотделительное ядро довгастого мозку передає регуляторні імпульси до привушних залоз через прегангліонарних волокна n. glossopharyngeus і n. petrosum minor, а потім через нейрони вушного вузла по волокнам скронево-вушного нерва.
Симпатична іннервація слинних залоз включає наступні ланки. Нейрони, від яких відходять прегангліонарних волокна, розташовуються в бічних рогах спинного мозку на рівні Th II -Th VI. Ці волокна підходять до верхнього шийного ганглію, де закінчуються на еферентних нейронах, що дають початок аксонам, що досягає привушних, підщелепних і під'язикові залоз (в складі судинного сплетення, навколишнього зовнішню сонну артерію).
На даний момент різними дослідниками накопичено значну кількість даних про те, які біохімічні посередники можуть брати участь в перенесенні регуляторних нервових імпульсів всередину секреторних клітин великих слинних залоз.Симпатичні волокна, що іннервують слинні залози, містять в своїх симпатичних закінченнях, як передбачається, переважно два нейромедіатора, норадреналін і адреналін. У науковій літературі є більше даних по дослідженню норадреналінового регуляції слинних залоз.
Вважається, що в регуляції роботи слинних залоз найбільшу роль відіграє парасимпатична іннервація, так як кожна їх клітина багато обплетена гілочками парасимпатических волокон. Передбачається, що кілька парасимпатических нейронів конвергує на одну клітку. Основним переносником парасимпатического сигналу до секреторних клітин слинних залоз є ацетилхолін . Іншим важливим нейромедіатором парасимпатических імпульсів, рецептори до якого локалізовані в основному в мукозних клітинах, є вазоактивний кишковий пептид (VIP).
Парасимпатичні нервові закінчення, що контактують з кровоносними капілярами в слинних залозах, містять, як вважається, переважно два нейромедіатора пептидної природи: VIP і субстанцію Р (SP). Передбачається, що останні беруть участь в контролі проникності гемато-саліварного бар'єру.
Крім цього, в нервових волокнах в слинних залозах були виявлені і інші нейромедіатори (аденозин трифосфат, гамма-амінобутирова кислота, гістамін, інсулін, нейрокинин А, кальцитонін ген-зв'язаний пептид), але їх участь у внутрішньоклітинної сигналізації секреторних клітин практично не вивчено.
Внутрішньоклітинна сигналізація, яка ініціюється нервовими імпульсами в секреторних клітинах слинних залоз, включає в себе наступні ланки: сигнальна молекула (нейромедіатор) → клітинний рецептор (трансмембранная білкова молекула) → регуляторний G-білок → специфічний фермент → вторинний низькомолекулярний переносник сигналу → вплив на певні внутрішньоклітинні процеси → виділення секреторного матеріалу (в нашому випадку - певних білків) в позаклітинне середовище.
У таблиці 2 представлені молекулярні посередники, які, як передбачається, забезпечують роботу головних гілок внутрішньоклітинної сигналізації в секреторних клітинах великих слинних залоз.
Незалежно від того, чи діє VIP- та SP-сигналізація переважно на гемато-саліварний бар'єр або ж одночасно і на секреторні клітини, очевидно, що нервова регуляція великих слинних залоз у кінцевому підсумку реалізується за трьома внутрішньоклітинним сигнальним шляхам. У першому випадку всередині секреторною клітини збільшується вміст діацілгліцерола, активатора протеїн кінази С, і інозитол 1,4,5-трифосфату, який підвищує рівень іонів Са 2+ в цитоплазмі. У другому - зростає внутрішньоклітинний рівень сАМР, а в третьому - концентрація сАМР навпаки знижується. У двох останніх випадках відбувається відповідно посилення або пригнічення активності Самро-залежною протеїн кінази. Ці три внутрішньоклітинних сигнальних механізму на завершальному етапі призводять до екзоцитозу секреторних гранул, що містять певні білкові компоненти.
Загальним обставиною для всіх цих сигнальних шляхів є те, що беруть участь в них клітинні рецептори відносяться до сімейства семи-доменних трансмембранних білків, які передають сигнал всередину клітини через GTP-зв'язуючі білки (G-білки).
Аналіз наукової літератури показує, що в даний час відсутня ясна картина про конкретні особливості пулу рецепторів на поверхні секреторних клітин слинних залоз людини, хоча і існують численні дані про вивчення цих рецепторів в слинних залозах людини і різноманітних тварин. З'ясування реального розподілу нейромедіаторних рецепторів відомих сімейств, таких як М (1,2,3,4,5), α 1 (А, В, D), α 2 (А, В, С), β (1,2,3 ) і ін., в певних видах (серозних, мукозних і змішаних) секреторних клітин тієї чи іншої слинної залози допоможе зрозуміти більш точно роботу ключового регуляторного ланки «нейромедіатор → секреторна клітина → білкова секреція» в механізмі контролю великих слинних залоз.
Резюмуючи все описане вище, можна сказати, що існують загальні для всіх людей анатомо-фізіологічні елементи управління білковим складом змішаної слини. На рис. 3 представлена принципова схема психофізіологічного механізму, що регулює білковий склад змішаної слини людини.
Певні емоції (психоемоційні стану) призводять до специфічної активації трьох центрів вегетативного контролю слинних залоз. З цих центрів передаються нервові імпульси, що управляють формуванням білкової секреції в секреторних клітинах великих слинних залоз. Можливо, що одночасно з тих же центрів паралельно йдуть сигнали, які модулюють білковий склад слини за допомогою зміни активності малих слинних залоз і проникності гемато-саліварного бар'єру.
Представлена нами в цій статті картина передбачуваної психофізіологічної регуляції білкового складу змішаної слини не є закінченою. Залишаються неясними багато питань. Безсумнівно, що дана область біології потребує серйозної уваги і копіткої дослідницької роботи.
До питань в області психофізіологічної регуляції слинних залоз, які вимагають подальших досліджень, можна, зокрема, віднести:
Чи є диференціація активності в структурі тел центрів вегетативної регуляції слинних залоз, яка розподіляється по декількох аксонам, або імпульси йдуть одним сумарним сигналом від кожного з цих центрів?
Чи регулюють вегетативні центри однаково праву і ліву слинних залоз в кожній з трьох пар великих слинних залоз або є певні відмінності?
Який внесок у формуванні білкового складу змішаної слини вносять: кожна з великих слинних залоз окремо; гемато-саліварний бар'єр; малі слинні залози?
Які біологічні функції виконують білки, секретуються в слину на тлі різних психоемоційних станів (тобто які медико-біологічні властивості набуває слина під дією різних емоцій)?
перспективи. Як видно з наведених вище даних, психоемоційний стан може досить сильно впливати на зміст в слині цілого спектра різних білкових речовин. Більшість цих білків контролюють певні фізіологічні процеси. Якщо припустити, що, аналогічно слинних, і інші залози схильні настільки ж сильний вплив психоемоційних станів (ми думаємо, що це буде з часом доведено), то вплив психічної активності на біохімічний фон (і як наслідок, на фізіологію) організму може виявитися досить масштабним .
У зв'язку з цим звертає на себе увагу той факт, що при деяких психічних розладах (наприклад, депресивному синдромі) лікування соматичних захворювань традиційними медикаментами малоефективно. Вчені, які зробили ці спостереження, поки не змогли дати ясного пояснення цього явища. Результати наших досліджень, можливо, надають реальну основу для розуміння причин. Як ми показали раніше, при депресивному синдромі кардинально змінюється біохімічна середовище (білковий склад) секреторних виділень з слинних залоз, внаслідок чого можуть істотно змінюватися різні метаболічні ланцюжка в організмі. Відповідно, можна припустити, що дія лікарських препаратів на такому тлі змінюється в порівнянні з ситуацією, коли психоемоційний стан характеризується нормальною активністю.
Отримані нами факти про психофізіологічної регуляції слинних залоз дозволяють припустити, що фундаментальна наука про людину ( психологія, [психо] фізіологія, нейрофізіологія, ендокринологія, клітинна біологія, біохімія) І практичну охорону здоров'я ( загальна медицина і психіатрія) Можуть отримати нові цінні можливості при використанні методів біохімічного аналізу слини.
Так в області фундаментальних досліджень метод аналізу білків слини дозволяє вивчати, як психічна активність впливає на:
секреторні процеси (роботу залоз) в організмі;
синтез білка в секреторних клітинах;
роботу генома секреторних клітин.
У широкому сенсі описаний метод надає можливості для дослідження механізмів, за допомогою яких здійснюється вплив з боку різних психоемоційних станів (нормалізують або дестабілізуючих) на функціонування різних фізіологічних систем.
Метод аналізу слини дозволяє засобами біохімії вивчати психічну активність в різних станах свідомості і когнітивної діяльності. З огляду на, що в даний час психофізіології та нейрофізіологія використовують переважно біофізичні методи, які в певному сенсі обтяжливі для випробовуваних людей, даний біохімічний метод може значно збільшити можливості дослідження психіки людини.
Справжній метод може бути у великій мірі цікавий як базова технологія для вивчення впливу психоемоційних станів на біохімічні процеси в організмі людини. Метод може бути використаний як «полігон» для підготовки аналогічних досліджень крові та інших біологічних середовищ людини.
У сфері охорони здоров'я даний метод може бути застосований для розробки засобів біохімічної (об'єктивної) оцінки психологічних особливостей особистості, що представляє певне значення для:
загальної медицини при необхідності обліку психофізіологічного станупацієнта, що могло б дозволити організувати найбільш доцільну терапію (як відомо, на тлі різних психоемоційних станів дію ліків різниться);
психіатрії при діагностиці психічних розладів (Слина відображає порушення в психічній сфері; слід зазначити, що пошук біологічних індикаторів психопатологий є актуальною медичною проблемою).
Робота підтримана Регіональним громадським фондом сприяння вітчизняній медицині (грант № З-01-2003).
ЛІТЕРАТУРА
1. Lac G. Saliva assays in clinical and research biology // Pathol. Biol. (Paris) 2001 49:8 660-7.
2. Tabak L.A. A revolution in biomedical assessment: the development of salivary diagnostics // Dent. Educ. 2001 65:12 1335-9.
3. Lawrence H.P. Salivary markers of systemic disease: noninvasive diagnosis of disease and monitoring of general health // J. Can. Dent. Assoc. 2002 68:3 170-4.
4. Nagler R.M., Hershkovich O., Lischinsky S., Diamond E., Reznick A.Z. Saliva analysis in the clinical setting: revisiting an underused diagnostic tool // J. Investig. Med. 2002 50:3 214-25.
5. Seifert G. Salivary glands and the organism-interrelations and correlating reactions // Laryngorhinootologie 1997 76:6 387-93.
6. Григор'єв І.В., Уланова Е.А., Ладик Б.Б. Деякі особливості білкового спектра змішаної слини у пацієнтів з депресивним синдромом // Клінічна лабораторна діагностика. 2002. № 1. С. 15-18.
7. Григор'єв І.В., Миколаєва Л.В., Артамонов І.Д. Психоемоційний стан людини впливає на білковий склад слини // біохімія. 2003. Т. 68. № 4. С. 501-503.
8. Бабаєва А. Г., Шубникова Е. А. Структура, функція і адаптивний зростання слинних залоз. М., Московський університет, 1979. 190 с.
9. Hajeer A.H., Balfour A.H., Mostratos A., Crosse B. Toxoplasma gondii: detection of antibodies in human saliva and serum // Parasite. Immunol. 1994. 16 (1): 43-50.
10. Brummer-Korvenkontio H., Lappalainen P., Reunala T., Palosuo T. Detection of mosquito saliva-specific IgE and IgG4 antibodies by immunoblotting // J. Allergy. Clin. Immunol. 1994. 93 (3): 551-555.
11. Покидова Н.В., Бабаян С.С., Журавльова Т.П., Ермольева З.В. Хімічні і фізико-хімічні властивості лізоциму людини // антибіотики. 1974. 19 (8): 721-724.
12. Kirstila V., Tenovuo J., Ruuskanen O., Nikoskelainen J., Irjala K., Vilja N. Salivary defense factors and oral health in patients with common variable immunodeficiency // J. Clin. Immunol. 1994. 14 (4): 229-236.
13. Jensen J.L., Xu T., Lamkin M.S., Brodin P., Aars H., Berg T., Oppenheim F.G. Physiological regulation of the secretion of histatins and statherins in human parotid saliva // J. Dent. Res. 1994. 73 (12): 1811-1817.
14. Aguirre A., Testa-Weintraub L.A., Banderas J.A, Haraszthy G.G., Reddy-M.S., Levine M.J. Sialochemistry: a diagnostic tool? // Crit. Rev. Oral. Biol. Med. 1993. 4 (3-4): 343-350.
15. Wu A.M., Csako G., Herp A. Structure, biosynthesis, and function of salivary mucins // Mol. Cell Biochem. 1994. 137 (1): 39-55.
16. Scannapieco F.A., Torres G., Levine M.J. Salivary alpha-amylase: role in dental plaque and caries formation // Crit. Rev. Oral. Biol. Med. 1993. 4 (3-4): 301-307.
17. Vanden-Abbeele A., Courtois P., Pourtois M. The antiseptic role of saliva // Rev. Belge. Med. Dent. 1992. 47 (3): 52-58.
18. Сукманскій О.І. Біологічно активні речовини слинних залоз. Київ, здоров'я. 1991.
19. Perinpanayagam H.E., Van-Wuyckhuyse B.C., Ji Z.S., Tabak L.A. Characterization of low-molecular-weght peptides in human parotid saliva // J.Dent.Res. 1995. 74 (1):345-350.
20. Pikula D.L., Harris E.F., Dasiderio D.M., Fridland G.H., Lovelace J.L. Methionine enkephalin-like, substance P-like, and beta-endorphin-like immunoreactivity in human parotid saliva // Arch. Oral. Biol. 1992. 37 (9): 705-709.
21. Dawidson I., Blom M., Lundeberg T., Theodorsson E., Angmar-Mansson B. Neuropeptides in the saliva of healthy subjects // Life Sci. 1997 60:4-5 269-78
22. Shiba A., Shiba K.S., Suzuki K. Analysis of salivary proteins by thin layer sodium dodecylsulphate polyacrylamide gel electrophoresis // J. Oral. Rehabil. 1986. 13 (3): 263-271.
23. Oberg S.G., Izutsu K.T., Truelove E.L. Human parotid saliva protein composition: dependence on physiological factors // Am. J. Physiol. 1982. 242 (3): G231-236.
24. Rahim Z.H., Yaakob H.B. Electrophoretic detection of salivary alpha-amylase activity // J. Nihon. Univ. Sch. Dent. 1992. 34 (4): 273-277.
25. Schwartz S. S., Zhu W. X., Sreebny L. M. Sodium dodecil sulphate-polyacrylamide gel electrophoresis of human whole saliva // Arch. Oral. Biol. 1995. 40 (10): 949-958.
26. Salvolini E., Mazzanti L., Martarelli D., Di Giorgio R., Fratto G., Curatola G. Changes in the composition of human unstimulated whole saliva with age // Aging (Milano) 1999 11:2 119-22.
27. Banderas-Tarabay JA, Zacarias-D-Oleire I.G., Garduno-Estrada R., Aceves-Luna E., Gonzalez-Begne M. Electrophoretic analysis of whole saliva and prevalence of dental caries. A study in Mexican dental students // Arch. Med. Res. 2002 33:5 499-505.
28. Guinard J.X., Zoumas-Morse C., Walchak C. Relation between parotid saliva flow and composition and the perception of gustatory and trigeminal stimuli in foods // Physiol. Behav. 1997 31 63:1 109-18.
29. Kugler J., Hess M., Haake D. Secretion of salivary immunoglobulin A in relation to age, saliva flow, mood states, secretion of albumin, cortisol, and catecholamines in saliva // J. Clin. Immunol. 1992. 12 (1): 45-49.
30. Hayakawa H., Yamashita K., Ohwaki K., Sawa M., Noguchi T., Iwata K., Hayakawa T. Collagenase activity and tissue inhibitor of metalloproteinases-1 (TIMP-1) content in human whole saliva from clinically healthy and periodontally diseased subjects // J. Periodontal. Res. 1994. 29 (5): 305-308.
31. Gasior-Chrzan B., Falk E.S. Lysozyme and IgA concentrations in serum and saliva from psoriatic patients // Acta Derm. Venereol. 1992. 72 (2): 138-140.
32. Ino M., Ushiro K., Ino C., Yamashita T., Kumazawa T. Kinetics of epidermal growth factor in saliva // Acta Otolaryngol. Suppl. Stockh. 1993. 500: 126-130.
33. Bergler W., Petroianu G., Metzler R. Disminucion del factor de crecimiento epidermico en la saliva en pacientes con carcinoma de la orofaringe // Acta. Otorrinolaringol. Esp. 1992. 43 (3): 173-175.
34. Mackinnon L.T., Hooper S. Mucosal (secretory) immune system responses to exercise of varying intensity and during overtraining // Int. J. Sports. Med. 1994. 3: S179-183.
35. Hu Y., Ruan M., Wang Q. A study of parotid salivary proteins from caries-free and caries-active people by high performance liquid chromatography // Zhonghua Kou Qiang Yi Xue Za Zhi 1997 32:2 95-8.
36. Salvolini E., Di Giorgio R., Curatola A., Mazzanti L., Fratto G. Biochemical modifications of human whole saliva induced by pregnancy // Br. J. Obstet. Gynaecol. 1998 105:6 656-60.
37. Henskens Y.M., van-der-Weijden F.A., van-den-Keijbus P.A., Veerman E.C., Timmerman M.F., van-der-Velden U., Amerongen A.V. Effect of periodontal treatment on the protein composition of whole and parotid saliva // J. Periodontol. 1996. 67 (3): 205-212.
38. Rudney J.D. Does variability in salivary protein concentrations influence oral microbial ecology and oral health? // Crit. Rev. Oral. Biol. Med. 1995. 6 (4): 343-367.
39. Sabbadini E., Berczi I. The submandibular gland: a key organ in the neuro-immuno-regulatory network? // Neuroimmunomodulation 1995 2:4 184-202.
40. Павлов І.П. Двадцятирічний досвід об'єктивного вивчення вищої нервової діяльності (поведінки) тварин. С.-Петербург, 1923.
41. Gemba H., Teranaka A., Takemura K. Influences of emotion upon parotid secretion in human // Neurosci. Lett. 1996 28 211:3 159-62
42. Bergdahl M., Bergdahl J. Low unstimulated salivary flow and subjective oral dryness: association with medication, anxiety, depression, and stress // J. Dent. Res. 2000 79:9 1652-8.
43. Doyle A., Hucklebridge F., Evans P., Clow A. Salivary monoamine oxidase A and B inhibitory activities correlate with stress // Life Sci. 1996 59:16 1357-62.
44. Smith-Hanrahan C. Salivary kallikrein output during the stress response to surgery // Can. J. Physiol. Pharmacol. 1997. 75 (4): 301-304.
45. Okumura T., Nakajima Y., Matsuoka M. et al. Study of salivary catecholamines using fully automated column-switching high-performance liquid chromatography // J. Chromatogr. Biomed. Appl. 1997. 694 (2): 305-316.
46. Kirschbaum C., Wust S., Hellhammer D. Consistent sex differences in cortisol responses to psychological stress // Psychosom. Med. 1992 54:6 648-57.
47. Лукаш О.І., Зайка В.Г., Мілютіна Н.П., Кучеренко А.О. інтенсивність вільно-радикальних процесів і активність антиоксидантних ферментів в слині та плазмі людини при емоційному стресі. Питання медичної хімії. 1999. 45: 6. 503-513.
48. Martin R.B., Guthrie C.A. Pitts C.G. Emotional crying, depressed mood, and secretory immunoglobulin A // Behav. Med. 1993. 19 (3): 111-114.
49. Hucklebridge F., Lambert S., Clow A., Warburton D.M., Evans P.D., Sherwood N. Modulation of secretory immunoglobulin A in saliva; response to manipulation of mood // Biol. Psychol. 2000. 53 (1): 25-35.
50. Evans P., Bristow M., Hucklebridge F., Clow A., Walters N. The relationship between secretory immunity, mood and life-events // Br.J.Clin.Psychol. 1993. 32 (Pt 2): 227-236.
51. Stephen B. P. Quantitative aspects of stress-induced immunomodulation. International Immunopharmacology, 2001, 1:3 :507-520.
52. Grander D.A., Weisz J.R., Kauneckis D. Neuroendocrine reactivity, internalizing behavior problems, and control-related cognitions in clinic-referred children and adolescents // J. Abnorm. Psychol. 1994. 103 (2): 267-276.
53. Kirkpatrick S.W., Campbell P.S., Wharry R.E. Robinson S.L. Salivary testosterone in children with and without learning disabilities // Physiol. Behav. - 1993. 53 (3): 583-586.
54. Davies R.H., Harris B., Thomas D.R., Cook N., Read G., Riad-Fahmy D. Salivary testosterone levels and major depressive illness in men // Br.J. Psychiatry. 1992. 161: 629-632.
55. Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T 4 // Nature. 1970. 227: 680-685.
56. Kusakabe T., Matsuda H., Gono Y., Kawakami T., Kurihara K., Tsukuda M., Takenaka T. Distribution of VIP receptors in the human submandibular gland: an immunohistochemical study // Histol. Histopathol. 1998 13:2 373-8.
57. Matsuda H., Kusakabe T., Kawakami T., Nagahara T., Takenaka T., Tsukuda M. Neuropeptide-containing nerve fibres in the human parotid gland: a semiquantitative analysis using an antibody against protein gene product 9.5 // Histochem. J. 1997 29:539-44.
58. Kawaguchi M., Yamagishi H. Receptive systems for drugs in salivary gland cells // Nippon Yakurigaku Zasshi 1995 105:5 295-303.
59. Dawidson I., Blom M., Lundeberg T., Theodorsson E., Angmar-Mansson B. Neuropeptides in the saliva of healthy subjects // Life Sci. 1997 60:4-5 269-78.
60. Beck-Sickinger A.G. Structural characterization and binding sites of G-protein-coupled receptors // DDT, V. 1, № 12, P. 502-512.
61. Уланова Е.А., Григор'єв І.В., Новикова И.А. Гемато-саліварние механізми регуляції в ревматоїдному артриті. Терапевтичний архів. 2001 73:11 92-4.
62. Won S., Kho H., Kim Y., Chung S., Lee S. Analysis of residual saliva and minor salivary gland secretions // Arch. Oral. Biol. 2001 46:619-24.
63. Wang P.S., Bohn R.L., Knight E., Glynn R.J., Mogun H., Avorn J. Noncompliance with antihypertensive medications: the impact of depressive symptoms and psychosocial factors // J. Gen. Intern. Med. 2002 17:7 504-11.
23.05.2013 , 1 253 , 0
Слина є продуктом діяльності трьох парних слинних залоз - привушних, підщелепних і під'язикові, а також великої кількості залозок, розсіяних в підслизової порожнини рота. У порожнині рота, куди через вивідні протоки залоз потрапляє слина, до неї приєднуються епітеліальні клітини, частинки їжі і. т. д. Це змішана слина, або ротова рідина: сюди входить також і слиз, що виробляється слизовими залозами порожнини рота. Чистий слина містить до 99% в оди, велика кількість муцину, фермент птіалін, різні солі і між ними роданистий калій. Реакція слини слаболужна. Питома вага слини 1,002-1,008.
Склад слини по Якович:
Добова кількість слини, що виділяється в середньому дорівнює 1,5 л. Як показали роботи школи Павлова, відділення слини настає в більшій чи меншій мірі при введенні їжі в рот, причому характер слиновиділення залежить від характеру їжі. На харчові речовини виділяється густа багата муцином «мастильна» слина, яка сприяє кращому проковтування; на речовини неїстівні, або, по Павлову, «відкидаємо», виділяється рідка водяниста слина, яка розріджує і знешкоджує ці речовини і відмиває від них слизову порожнину рота.
Слина починає виділятися тільки при введенні їжі в рот, але навіть при одній думці про їжу, при дії деяких харчових речовин своїм запахом, смаком і т. П. Навіть на відстані. Раніше це явище було відоме під назвою «психічного слиновиділення». В даний час доведено, що це придбане, а не вроджена властивість і залежить від того, що відомі рефлекси, до яких треба віднести і слиновиділення від запаху, можуть бути викликані не тільки істинним подразником, але і яким-небудь іншим, пов'язаним з ним по часу і сигналізує його. Це так званий умовний рефлекс.
Взагалі ж відділення слини здійснюється за допомогою специфічних секреторних слинних залоз. Іннервація слинних залоз двояка: з одного боку, нервами безпосередньо з центральної нервової системи, а з іншого - волокнами системи, які йдуть від шийного симпатичного стовбура.
Кожна пара слинних залоз виділяє секрет різного складу. Привушні залози: слину рідку, серозну, білкову, яка містить значно менше твердих речовин, причому найбільше з солей представлені тут хлористий калій і хлористий натрій. Вуглекислий кальцій розчинений в, слині у вигляді двууглекислой солі. Якщо залишити стояти слину, отриману прямо з привушної залози, то вапно випадає у вигляді вуглекислого вапна. Це ж явище ми спостерігаємо і в роті, коли в області вивідної протоки привушної залози - ductus Stenonianus - на молярах відкладається зубний камінь.
З органічних сполук в слині привушної залози найважливішим є диастатический фермент - птіалін, який розкладає крохмаль на декстрин і декстрозу. Околоушная залоза виділяє також роданистий калій. Крім того, в слині міститься каталаза, яка розщеплює Н? Про? на Н? О і О. При полосканні перекисом водню утворюється піна, особливо при наявності ран або гною в порожнині рота. Відомо, що кров і гній володіють сильним каталітичним дією.
Слина містить ще протеолітичний фермент, який пов'язаний з лейкоцитами слини - слинними тільцями, які, зважаючи на вміст в них цього ферменту, зараховуються до лейкоцитів, а не до лімфоцитів.
У новітній час роботами Принца і Меллера встановлено в слині наявність оксидази і пероксидази. Вони переносять активний кисень з перекисів на окислюються тканини.
З підщелепної залози виділяється змішаний секрет, який містить велику кількість органічних речовин, найбільше муцина, птиалина, а також невелика кількість роданистого калію. З солей зустрічається раніше всього хлористий натрій, хлористий кальцій, вуглекислий і фосфорнокислий кальцій і фосфорнокисла магнезія. При відстоюванні слини осідають вуглекисла вапно і білкова речовина. Зміст птиалина тут значно менше, ніж в слині привушної залози.
Під'язикова залоза виділяє слину, найбільш багату муцином; ця слина має лужної реакцією, в'язка, клейка і тягнеться нитками. Зміст роданистого калію в ній дуже мало - лише сліди.
Слина є електролітно-колоїдної системою і відноситься до іонно-дисперсних розчинів.
З питання про реакцію слини при різних захворюваннях зубів роботами Сабо встановлено, що при карієсі, пульпіті і особливо при гангрени пульпи реакція слини переважно лужна. Останнім часом знову приділяється багато уваги вивченню реакцій слини в зв'язку з роботами по ревізії теорій каріозного процесу. Однак спостереження над середніми числами добових коливань концентрації водневих іонів показали, що в загальному, коливання ці зовсім незначні і що протягом дня реакція слини переважно нейтральна (рН = 7,1 - 7,32).
| Статті по темі: | |
|
функції травлення
text_fields text_fields arrow_upward Життя - розвиток, ... В яких громадських місцях не можна знаходиться в нетверезому вигляді
Людина напідпитку - явище нерідке. Але якщо деякі люди продовжують ... Питання: Близький мені людина постійно курить план
Господа і дами - ми над АмстердамомРазрешается курити, все йде по ... | |